题目内容
7.甲同学将Na2O2分别与H2O和浓盐酸反应,有如下现象:| 实验序号 | 使用药品 | 现象 |
| Ⅰ | Na2O2、H2O | ①试管壁发热 ②有无色无味气体产生 |
| Ⅱ | Na2O2、浓盐酸 | ①试管壁发热 ②有刺激性气味的气体产生 ③反应后所得溶液呈浅黄绿色 |
实验I中:
(1)该反应是放热反应(填“放热”或“吸热”).
(2)反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
(3)证明无色无味气体是氧气的方法是将带火星的木条放在试管口,复燃则证明是氧气.
实验Ⅱ中:
(4)根据现象②、③,推测生成的气体中可能含有Cl2,产生Cl2的化学方程式是Na2O2+4HCl(浓)=2NaCl+Cl2↑+2H2O.
(5)若往“浅黄绿色溶液”中加入FeCl3溶液,立即产生与实验Ⅰ相同的气体,原因是黄绿色溶液中存在H2O2,加入FeCl3使H2O2分解速率加快,立即产生氧气.
分析 (1)试管壁发热,说明反应是放热反应;
(2)过氧化钠与水反应生成氢氧化钠和氧气,由此书写化学方程式;
(3)证明氧气的方法是带火星的木条放在试管口,复燃则证明是氧气;
(4)有刺激性气味的气体产生、反应后所得溶液呈浅黄绿色,说明应气体是氯气,过氧化钠氧化浓盐酸生成氯气,由此书写化学方程式;
(5)随反应的进行浓盐酸变稀盐酸,而稀盐酸与Na2O2发生复分解生成过氧化氢,所以溶液中存在过氧化氢,在氯化铁催化作用下产生氧气,所以有无色无味气体产生.
解答 解:(1)现象试管壁发热,说明反应是放热反应,故答案为:放热;
(2)过氧化钠与水反应生成氢氧化钠和氧气,方程式为:2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(3)证明氧气的方法是带火星的木条放在试管口,复燃则证明是氧气,故答案为:将带火星的木条放在试管口,复燃则证明是氧气;
(4)有刺激性气味的气体产生、反应后所得溶液呈浅黄绿色,说明应气体是氯气,过氧化钠氧化浓盐酸生成氯气,方程式为:Na2O2+4HCl(浓)=2NaCl+Cl2↑+2H2O,故答案为:Na2O2+4HCl(浓)=2NaCl+Cl2↑+2H2O;
(5)随反应的进行浓盐酸变稀盐酸,而稀盐酸与Na2O2发生复分解生成过氧化氢,所以溶液中存在过氧化氢,在氯化铁催化作用下产生氧气,故答案为:黄绿色溶液中存在H2O2,加入FeCl3使H2O2分解速率加快,立即产生氧气.
点评 本题考查性质实验探究,侧重考查学生动手操作、分析问题能力,物质的性质是实验设计的依据,性质、制备实验方案设计是高考高频点,综合性较强,涉及知识点较多,熟练掌握元素化合物知识,题目难度中等.

练习册系列答案
相关题目
15.能有效防止铁质栏杆锈蚀的措施是( )
| A. | 接上铜网 | B. | 与石墨相连 | C. | 定期涂上油漆 | D. | 定期擦去铁锈 |
12.下列物质中,只有氧化性、只有还原性,既有氧化性又有还原性的顺序排列的一组是( )
| A. | F2、K、Cl2 | B. | Cl2、Al、H2 | C. | NO2、Na、Br2 | D. | O2、SO2、H2O |
19.下列行为不符合安全要求的是( )
| A. | 将做实验剩余的药品带回家 | |
| B. | 闻气体时用手轻轻扇动,使少量气体飘进鼻孔 | |
| C. | 配制稀硫酸时将浓硫酸慢慢倒入水中并不断搅拌 | |
| D. | 不慎洒出的酒精在桌上着火时,立即用湿毛巾盖灭 |
16. 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
(1)将浓度为0.1mol•L-1 HF溶液加水稀释一倍(假设温度不变),下列各量增大的是CD.
A.c(H+) B.c(H+)•c(OH-) C.$\frac{c({H}^{+})}{c(HF)}$ D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
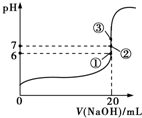
(2)25℃时,在20mL 0.1mol•L-1氢氟酸中加入V mL 0.1mol•L-1 NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是BC.
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中c(F-)-c(Na+)=9.9×10-7 mol•L-1
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol•L-1
(3)物质的量浓度均为0.1mol•L-1的下列四种溶液:①Na2CO3溶液;②NaHCO3溶液;③NaF溶液;④NaClO溶液.依据数据判断pH由大到小的顺序是①④②③.(用序号填写)
(4)Na2CO3溶液显碱性是因为CO${\;}_{3}^{2-}$水解的缘故,请设计简单的实验事实证明之在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅.
(5)长期以来,一直认为氟的含氧酸不存在.1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F.HFO与水反应得到HF和化合物A,每生成1mol HF转移1mol电子.
 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数(Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
A.c(H+) B.c(H+)•c(OH-) C.$\frac{c({H}^{+})}{c(HF)}$ D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)25℃时,在20mL 0.1mol•L-1氢氟酸中加入V mL 0.1mol•L-1 NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是BC.
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中c(F-)-c(Na+)=9.9×10-7 mol•L-1
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol•L-1
(3)物质的量浓度均为0.1mol•L-1的下列四种溶液:①Na2CO3溶液;②NaHCO3溶液;③NaF溶液;④NaClO溶液.依据数据判断pH由大到小的顺序是①④②③.(用序号填写)
(4)Na2CO3溶液显碱性是因为CO${\;}_{3}^{2-}$水解的缘故,请设计简单的实验事实证明之在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅.
(5)长期以来,一直认为氟的含氧酸不存在.1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F.HFO与水反应得到HF和化合物A,每生成1mol HF转移1mol电子.
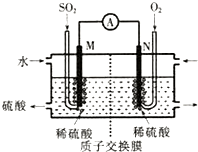 硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图所示(电极均为惰性材料):M极发生的电极反应式为SO2+2H2O-2e-=SO42-+4H+.
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图所示(电极均为惰性材料):M极发生的电极反应式为SO2+2H2O-2e-=SO42-+4H+. .
.