题目内容
实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定NaOH的质量分数约为82.0%,为了验证其纯度,用浓度为0.2mol/L的盐酸进行滴定,试回答下列问题:
(1)托盘天平称量5.00g固体试剂,用蒸馏水溶解于烧杯中,并用玻璃棒搅拌;立即用玻璃棒引流转入 500mL容量瓶中,并洗涤烧杯,将液体也转入容量瓶中,恰好至刻度线;振荡配成待测液备用.请改正以上叙述出现的3处错误:
(2)将标准盐酸装在25.00mL
(3)取20.00mL待测液,所用仪器有
(4)滴定达终点后,记下盐酸用去20.00mL,计算NaOH的质量分数为
(5)试分析结果偏低可能由下列哪些实验操作引起的
A.转移待测液至容量瓶时,未洗涤烧杯
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸
C.滴定时,反应容器摇动太激烈,有少量液体溅出
D.滴定到终点时,滴定管尖嘴悬有液滴
E.读酸式滴定管开始时仰视,读终点时俯视.
(1)托盘天平称量5.00g固体试剂,用蒸馏水溶解于烧杯中,并用玻璃棒搅拌;立即用玻璃棒引流转入 500mL容量瓶中,并洗涤烧杯,将液体也转入容量瓶中,恰好至刻度线;振荡配成待测液备用.请改正以上叙述出现的3处错误:
天平精确度
天平精确度
、没有冷却就转移液体
没有冷却就转移液体
、定容没有使用胶头滴管
定容没有使用胶头滴管
.(2)将标准盐酸装在25.00mL
酸式
酸式
滴定管中,调节液面,并记下初始刻度.(3)取20.00mL待测液,所用仪器有
碱式滴定管或移液管
碱式滴定管或移液管
,取后待用.用甲基橙作指示剂时,滴定到溶液颜色由黄色
黄色
刚好至橙
橙
色时为止.(4)滴定达终点后,记下盐酸用去20.00mL,计算NaOH的质量分数为
80%
80%
.(5)试分析结果偏低可能由下列哪些实验操作引起的
ACE
ACE
.A.转移待测液至容量瓶时,未洗涤烧杯
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸
C.滴定时,反应容器摇动太激烈,有少量液体溅出
D.滴定到终点时,滴定管尖嘴悬有液滴
E.读酸式滴定管开始时仰视,读终点时俯视.
分析:(1)托盘天平的感量为0.1g,溶解后的溶液应冷却后转移,定容应使用胶头滴管;
(2)盐酸应用酸式滴定管量取;
(3)待测液为NaOH,选择碱式滴定管或移液管;用甲基橙作指示剂时,滴定前,甲基橙遇碱变黄,滴定后若变橙色,停止滴定;
(4)c(HCl)=0.2mol/L,V(HCl)=20.00mL,V(NaOH)=20.00mL,由c(酸)V(酸)=c(碱)V(碱)计算c(NaOH),进一步计算500mL溶液中NaOH的物质的量,利用样品的质量5.0g计算质量分数;
(5)A.转移待测液至容量瓶时,未洗涤烧杯,NaOH的物质的量减少;
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸,盐酸的浓度偏低,消耗酸偏大;
C.滴定时,反应容器摇动太激烈,有少量液体溅出,NaOH的物质的量减少;
D.滴定到终点时,滴定管尖嘴悬有液滴,消耗盐酸偏大;
E.读酸式滴定管开始时仰视,读数偏大,而读终点时俯视,读数偏小,二者之差偏小.
(2)盐酸应用酸式滴定管量取;
(3)待测液为NaOH,选择碱式滴定管或移液管;用甲基橙作指示剂时,滴定前,甲基橙遇碱变黄,滴定后若变橙色,停止滴定;
(4)c(HCl)=0.2mol/L,V(HCl)=20.00mL,V(NaOH)=20.00mL,由c(酸)V(酸)=c(碱)V(碱)计算c(NaOH),进一步计算500mL溶液中NaOH的物质的量,利用样品的质量5.0g计算质量分数;
(5)A.转移待测液至容量瓶时,未洗涤烧杯,NaOH的物质的量减少;
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸,盐酸的浓度偏低,消耗酸偏大;
C.滴定时,反应容器摇动太激烈,有少量液体溅出,NaOH的物质的量减少;
D.滴定到终点时,滴定管尖嘴悬有液滴,消耗盐酸偏大;
E.读酸式滴定管开始时仰视,读数偏大,而读终点时俯视,读数偏小,二者之差偏小.
解答:解:(1)托盘天平的感量为0.1g,不能称量5.00g固体,溶解后的溶液应冷却后转移,定容应使用胶头滴管,即错误之处为天平精确度、没有冷却就转移液体、定容没有使用胶头滴管,故答案为:天平精确度;没有冷却就转移液体;定容没有使用胶头滴管;
(2)盐酸应用酸式滴定管量取,故答案为:酸式;
(3)待测液为NaOH,选择碱式滴定管或移液管;用甲基橙作指示剂时,滴定前,甲基橙遇碱变黄,到达滴定终点时观察到溶液颜色由黄色变为橙色,
故答案为:碱式滴定管或移液管;黄色;橙;
(4)c(HCl)=0.2mol/L,V(HCl)=20.00mL,V(NaOH)=20.00mL,由c(酸)V(酸)=c(碱)V(碱)可知c(NaOH)=0.2mol/L,
则500mL溶液中NaOH的物质的量为0.5L×0.2mol/L=0.1mol,则NaOH的质量为0.1mol×40g/mol=4.0g,所以5.0g样品中NaOH的质量分数为
×100%=80%,
故答案为:80%;
(5)A.转移待测液至容量瓶时,未洗涤烧杯,NaOH的物质的量减少,消耗酸减少,则结果偏低,故A正确;
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸,盐酸的浓度偏低,消耗酸偏大,结果偏大,故B错误;
C.滴定时,反应容器摇动太激烈,有少量液体溅出,NaOH的物质的量减少,消耗酸减少,则结果偏低,故C正确;
D.滴定到终点时,滴定管尖嘴悬有液滴,消耗盐酸偏大,结果偏大,故D错误;
E.读酸式滴定管开始时仰视,读数偏大,而读终点时俯视,读数偏小,二者之差偏小,消耗酸减少,则结果偏低,故E正确;
故答案为:ACE.
(2)盐酸应用酸式滴定管量取,故答案为:酸式;
(3)待测液为NaOH,选择碱式滴定管或移液管;用甲基橙作指示剂时,滴定前,甲基橙遇碱变黄,到达滴定终点时观察到溶液颜色由黄色变为橙色,
故答案为:碱式滴定管或移液管;黄色;橙;
(4)c(HCl)=0.2mol/L,V(HCl)=20.00mL,V(NaOH)=20.00mL,由c(酸)V(酸)=c(碱)V(碱)可知c(NaOH)=0.2mol/L,
则500mL溶液中NaOH的物质的量为0.5L×0.2mol/L=0.1mol,则NaOH的质量为0.1mol×40g/mol=4.0g,所以5.0g样品中NaOH的质量分数为
| 4.0g |
| 5.0g |
故答案为:80%;
(5)A.转移待测液至容量瓶时,未洗涤烧杯,NaOH的物质的量减少,消耗酸减少,则结果偏低,故A正确;
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸,盐酸的浓度偏低,消耗酸偏大,结果偏大,故B错误;
C.滴定时,反应容器摇动太激烈,有少量液体溅出,NaOH的物质的量减少,消耗酸减少,则结果偏低,故C正确;
D.滴定到终点时,滴定管尖嘴悬有液滴,消耗盐酸偏大,结果偏大,故D错误;
E.读酸式滴定管开始时仰视,读数偏大,而读终点时俯视,读数偏小,二者之差偏小,消耗酸减少,则结果偏低,故E正确;
故答案为:ACE.
点评:本题考查中和滴定操作,题目难度中等,注意把握实验基本方法,能会分析导致误差的不当操作,注意把握实验操作要点和注意事项.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯: CH3CH2OH CH2=CH2↑+H2O,加热一段时间后溶液中有黑色现象出现。过一段时间后,经硫酸酸化的高锰酸钾溶液褪色。经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O。
CH2=CH2↑+H2O,加热一段时间后溶液中有黑色现象出现。过一段时间后,经硫酸酸化的高锰酸钾溶液褪色。经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O。
酸性高锰酸钾溶液褪色,甲同学认为能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为不能证明乙烯被酸性高锰酸钾溶液氧化了。
(1)你认为哪个同学的观点正确? _____ (填“甲”或“乙”),理由是(从下列选项中选)_____
| A.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了氧化反应 |
| B.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了加成反应 |
| C.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,不能证明通入的气体是纯净物 |
| D.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,只能证明通入的气体一定具有还原性 |
(3)丁同学想证明乙烯能否与溴发生反应,于是对上述实验进行了改进,改进的方法是:在装置(Ⅰ)和(Ⅱ)之间增加一个装有足量_____的洗气瓶,且将(Ⅱ)瓶中溶液换成_____ 。发生加成反应的化学方程式为
 Ⅰ.下列实验操作或对实验事实的描述不正确的是
Ⅰ.下列实验操作或对实验事实的描述不正确的是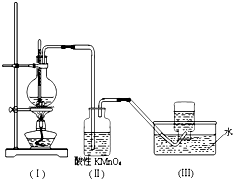 如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后观察到烧瓶中溶液变黑,装置(Ⅱ)中经硫酸酸化的高锰酸钾溶液褪色.
如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后观察到烧瓶中溶液变黑,装置(Ⅱ)中经硫酸酸化的高锰酸钾溶液褪色. Ⅰ.下列实验操作或对实验事实的描述不正确的是______ (填序号).
Ⅰ.下列实验操作或对实验事实的描述不正确的是______ (填序号).