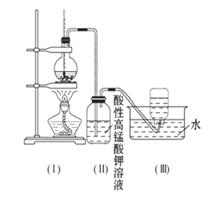
��Ŀ����
 ��ͼ��ʾ����ʵ�����ͨ������Ũ�������Ҵ���ϼ�������ϩ������һ��ʱ���۲쵽��ƿ����Һ��ڣ�װ�ã����о������ữ�ĸ��������Һ��ɫ��
��ͼ��ʾ����ʵ�����ͨ������Ũ�������Ҵ���ϼ�������ϩ������һ��ʱ���۲쵽��ƿ����Һ��ڣ�װ�ã����о������ữ�ĸ��������Һ��ɫ����1����ͬѧ��Ϊ���Ը��������Һ��ɫ����֤����ϩ�����Ը��������Һ�����ˣ�����Ϊ��ͬѧ�Ĺ۵��Ƿ���ȷ��
A������ƿ�����Ը��������Һ��ɫ����֤����ϩ������������Ӧ
B������ƿ�����Ը��������Һ��ɫ����֤����ϩ�����˼ӳɷ�Ӧ
C������ƿ�����Ը��������Һ��ɫ������֤��ͨ��������Ǵ�����
D������ƿ�����Ը��������Һ��ɫ��ֻ��֤��ͨ�������һ�����л�ԭ��
��2����ͬѧȡ����ƿ��������Һ���Թ������������Ȼ�����Һ��������ɫ�������ݴ�����Ϊ��ϩ��һ��
����SO2������Ϊ���Ľ����Ƿ�ɿ���
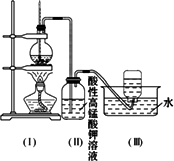
��3����ͬѧ��װ�ã��ͣ���֮��������һ��װ������
��������1��Ũ�������Ҵ���ϼ�������ϩ������һ��ʱ���۲쵽��ƿ����Һ��ڣ�˵��Ũ���������Ҵ�����̼��ͬʱ��������ԭ���Ƶõ���ϩ������ͨ���Ậ��CO2��SO2�����壬���������������ܷ���������ԭ��Ӧ�����������ɫ��
��2�������ữ�ĸ��������Һ�б����ͺ���SO42-�����ö����������Ư������ʹƷ����ɫ�������������ڣ�
��3����ȥ����������ü�Һ�������գ���װ�ã��ͣ���֮��������һ��װ����������������Һ��ϴ��װ�ã��ɱ�֤�����Ը��������Һ���õ�����ϩ��
��2�������ữ�ĸ��������Һ�б����ͺ���SO42-�����ö����������Ư������ʹƷ����ɫ�������������ڣ�
��3����ȥ����������ü�Һ�������գ���װ�ã��ͣ���֮��������һ��װ����������������Һ��ϴ��װ�ã��ɱ�֤�����Ը��������Һ���õ�����ϩ��
����⣺��1��Ũ�������ǿ�����ԣ��������Ҵ������Ҵ�������̼��ͬʱ��������ԭ�ɶ��������������������ط�Ӧ5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4��ɫ����ϩ�����������Һ����5CH2=CH2+12KMnO4+18H2SO4��10CO2+12MnSO4+28H2O+6K2SO4�����¸��������Һ��ɫ��
A������ƿ�����Ը��������Һ��ɫ�������Ƕ��������������ط�Ӧ����A����
B������ƿ�����Ը��������Һ��ɫ����������ϩ�����������������B����
C����ʹ���������ɫ���ж����������ϩ�����Բ���֤��ͨ��������Ǵ������C��ȷ��
D�������Ƕ�����������ϩ��ʹ���������ɫ�������������ط���������ԭ��Ӧ���Ҹ���������������������ǻ�ԭ�����л�ԭ�ԣ���D��ȷ��
�ʴ�Ϊ����CD��
��2��װ�ã�����װ�о������ữ�ĸ��������Һ�������ữ������������ӣ�����������Ȼ�����Һ��������ɫ����������˵���Ƕ�������������������ã��Ľ�ʵ�鷽��֤����ϩ���Ƿ���SO2�������ö����������Ư���ԣ���ʹƷ����ɫ���м��飬�����ǽ�����ƿ����Һ����Ʒ����Һ��
�ʴ�Ϊ���������ữ�ĸ��������Һ�б����ͺ���SO42-��������ƿ����Һ����Ʒ����Һ��
��3�����������ܺ��������Ʒ�Ӧ�����κ�ˮ����ϩ���������Ʋ���Ӧ����װ�ã��ͣ���֮��������һ��װ����������������Һ��ϴ��װ�ã��ɳ�ȥ��ϩ�еĶ������ɱ�֤ʹ���Ը��������Һ��ɫֻ����ϩ��
�ʴ�Ϊ���������ƣ�
A������ƿ�����Ը��������Һ��ɫ�������Ƕ��������������ط�Ӧ����A����
B������ƿ�����Ը��������Һ��ɫ����������ϩ�����������������B����
C����ʹ���������ɫ���ж����������ϩ�����Բ���֤��ͨ��������Ǵ������C��ȷ��
D�������Ƕ�����������ϩ��ʹ���������ɫ�������������ط���������ԭ��Ӧ���Ҹ���������������������ǻ�ԭ�����л�ԭ�ԣ���D��ȷ��
�ʴ�Ϊ����CD��
��2��װ�ã�����װ�о������ữ�ĸ��������Һ�������ữ������������ӣ�����������Ȼ�����Һ��������ɫ����������˵���Ƕ�������������������ã��Ľ�ʵ�鷽��֤����ϩ���Ƿ���SO2�������ö����������Ư���ԣ���ʹƷ����ɫ���м��飬�����ǽ�����ƿ����Һ����Ʒ����Һ��
�ʴ�Ϊ���������ữ�ĸ��������Һ�б����ͺ���SO42-��������ƿ����Һ����Ʒ����Һ��
��3�����������ܺ��������Ʒ�Ӧ�����κ�ˮ����ϩ���������Ʋ���Ӧ����װ�ã��ͣ���֮��������һ��װ����������������Һ��ϴ��װ�ã��ɳ�ȥ��ϩ�еĶ������ɱ�֤ʹ���Ը��������Һ��ɫֻ����ϩ��
�ʴ�Ϊ���������ƣ�
���������⿼����ʵ��������ϩ������ļ��飬����������ʵĻ�����ѧ�����ǽ����Ĺؼ�����2����������ӵļ����Ǹ�����״��㣬��Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
��ͼ��ʾ����ʵ�����ͨ������Ũ�������Ҵ���ϼ�������ϩ: CH3CH2OH CH2=CH2��+H2O������һ��ʱ�����Һ���к�ɫ������֡���һ��ʱ��������ữ�ĸ��������Һ��ɫ����������֪�������������к���CH2=CH2��SO2��CO2��H2O��
CH2=CH2��+H2O������һ��ʱ�����Һ���к�ɫ������֡���һ��ʱ��������ữ�ĸ��������Һ��ɫ����������֪�������������к���CH2=CH2��SO2��CO2��H2O��
���Ը��������Һ��ɫ����ͬѧ��Ϊ��֤����ϩ�����Ը��������Һ�����ˣ���ͬѧ��Ϊ����֤����ϩ�����Ը��������Һ�����ˡ�
��1������Ϊ�ĸ�ͬѧ�Ĺ۵���ȷ�� _____ ����ס����ҡ����������ǣ�������ѡ����ѡ��_____
| A��(��)ƿ�����Ը��������Һ��ɫ����֤����ϩ������������Ӧ |
| B��(��)ƿ�����Ը��������Һ��ɫ����֤����ϩ�����˼ӳɷ�Ӧ |
| C��(��ƿ�����Ը��������Һ��ɫ������֤��ͨ��������Ǵ����� |
| D��(��)ƿ�����Ը��������Һ��ɫ��ֻ��֤��ͨ�������һ�����л�ԭ�� |
��3����ͬѧ��֤����ϩ�ܷ����巢����Ӧ�����Ƕ�����ʵ������˸Ľ����Ľ��ķ����ǣ���װ�ã��ͣ���֮������һ��װ������_____��ϴ��ƿ���ҽ�����ƿ����Һ����_____ �������ӳɷ�Ӧ�Ļ�ѧ����ʽΪ
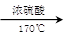 CH2=CH2��+H2O������һ��ʱ�����Һ���к�ɫ������֡���һ��ʱ��������ữ�ĸ��������Һ��ɫ����������֪�������������к���CH2=CH2��SO2��CO2��H2O��
CH2=CH2��+H2O������һ��ʱ�����Һ���к�ɫ������֡���һ��ʱ��������ữ�ĸ��������Һ��ɫ����������֪�������������к���CH2=CH2��SO2��CO2��H2O��