题目内容
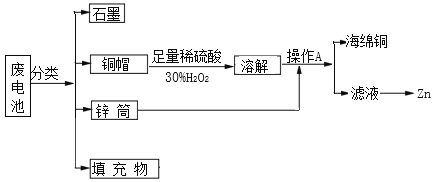
【题目】“垃圾是放错了位置的资源”,应该分类回收。某化学兴趣小组拟采用如下处理方法回收废电池中的资源。
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+ Zn(OH)2,其正极的电极反应式为_________。
(2)铜帽溶解时加入H2O2的目的是___________________ (用化学方程式表示)。铜帽溶解完全后,可采用________ 方法除去溶液中过量的H2O2。
(3)填充物中可以回收得到氯化铵,写出氯化铵溶液中各离子浓度的大小顺序______。
(4)铜器在潮湿环境中发生的电化学腐蚀如图所示:
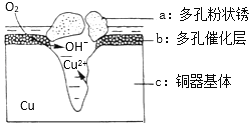
环境中的Cl﹣扩散到孔口,并与正极反应产物和负极产物作用生成多孔粉状锈Cu2(OH)3Cl,其若生成4.29g Cu2(OH)3Cl,则理论上消耗氧气体积为______L(标准状况)。
【答案】MnO2+e-+H2O=MnOOH+OH- Cu+H2O2+H2SO4=CuSO4+2H2O 加热 c(Cl-)>c(NH![]() )>c(H+)>c(OH-) 0.448
)>c(H+)>c(OH-) 0.448
【解析】
在碱性锌锰干电池中,电极为锌和碳棒,电解质为KOH,在负极:Zn-2e- +2OH- =Zn(OH)2,在正极:2MnO2+2e-+2H2O=2MnOOH+2OH-,所以废电池中,电池周围被锌筒包围,中间有碳棒,碳棒上有铜帽,填充物为MnO2、NH4Cl、MnOOH、 Zn(OH)2等。将它们分离后,铜帽加入足量稀硫酸和30%H2O2,发生反应Cu+H2O2+H2SO4=CuSO4+2H2O,溶解后加入锌筒,发生反应Zn+Cu2+=Zn2++Cu,然后过滤,得到海绵铜和含有Zn2+的滤液。
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+ Zn(OH)2,其正极的电极反应式为MnO2+e-+H2O=MnOOH+OH-。答案为:MnO2+e-+H2O=MnOOH+OH-;
(2)铜帽溶解时加入H2O2的目的,是将Cu氧化并最终转化为CuSO4,发生反应的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O。因为H2O2受热后易分解生成氧气和水,所以铜帽溶解完全后,可采用加热方法除去溶液中过量的H2O2。答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;加热;
(3)填充物中可以回收得到氯化铵,在氯化铵溶液中发生如下电离与水解:NH4Cl=NH4++Cl-,NH![]() +H2O
+H2O![]() NH3·H2O + H+,H2O
NH3·H2O + H+,H2O![]() H++OH-,所以各离子浓度的大小顺序c(Cl-)>c(NH
H++OH-,所以各离子浓度的大小顺序c(Cl-)>c(NH![]() )>c(H+)>c(OH-)。答案为:c(Cl-)>c(NH
)>c(H+)>c(OH-)。答案为:c(Cl-)>c(NH![]() )>c(H+)>c(OH-);
)>c(H+)>c(OH-);
(4)铜器在潮湿环境中发生电化学腐蚀,负极2Cu-4e-=2Cu2+,正极O2+4e-+2H2O=4OH-,环境中的Cl﹣扩散到孔口,并与正极反应产物和负极产物作用生成多孔粉状锈Cu2(OH)3Cl,发生反应的离子方程式为2Cu2++3OH-+Cl-= Cu2(OH)3Cl↓,由此可得出关系式:2Cu——O2——Cu2(OH)3Cl,若生成4.29g Cu2(OH)3Cl,则理论上消耗氧气体积为![]() =0.448L。答案为:0.448。
=0.448L。答案为:0.448。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案