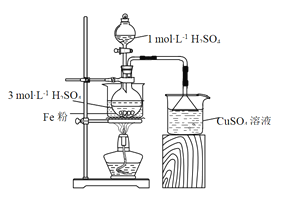
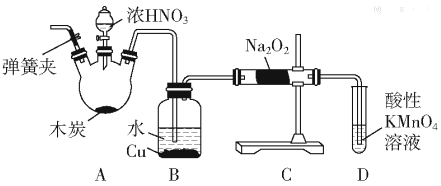
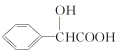
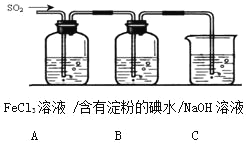
题目内容
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg(V/V0)的变化如图所示。
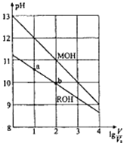
(1)MOH是___(填“强碱”或“弱碱”)。
(2)写出ROH的电离方程式___。
(3)若溶液体积相等,为了使MOH溶液与ROH溶液稀释后pH相等,加入水较多的是___。
(4)常温下,在ROH溶液中加蒸馏水稀释,下列物理量变大的是___。
A.Kw B.![]() C.c(H+) D.c(OH-)
C.c(H+) D.c(OH-)
(5)ROH的电离程度:b点___a点(填“大于”、“小于”或“等于”,下同);若无限稀释MOH、ROH溶液,最终溶液的pH:MOH溶液___ROH溶液。
【答案】强碱 ROH![]() R++OH- MOH BC 大于 等于
R++OH- MOH BC 大于 等于
【解析】
(1)、0.10mol/L的MOH pH为13,故MOH是强碱;
(2)、0.10mol/L的ROH pH不为13,故ROH是弱碱,所以电离方程式为ROH![]() R++OH-;
R++OH-;
(3)、由图可知,稀释至相同pH,即做一条垂直于Y轴的垂线,所以加水较多的为MOH;
(4)、Kw随温度变化,A不选;![]() =
=![]() ,稀释碱性变弱,c(OH-)降低,故
,稀释碱性变弱,c(OH-)降低,故![]() 增大,c(OH-)降低,所以选B,不选D;稀释碱性变弱,c(H+)增大,C选,故答案为:BC;
增大,c(OH-)降低,所以选B,不选D;稀释碱性变弱,c(H+)增大,C选,故答案为:BC;
(5)、加水稀释,促进弱碱的电离,所以b点电离程度大于a点,若无限稀释MOH、ROH溶液,最终溶液的pH为7,相等,故答案为:大于,等于;

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目