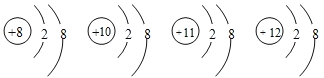题目内容
【题目】现有部分前四周期元素的性质或原子结构如下表:

(1)B单质分子中,含有________个![]() 键和__________个
键和__________个![]() 键,元素B的气态氢化物的空间型为________________。
键,元素B的气态氢化物的空间型为________________。
(2)C单质的熔点____________A单质的熔点(填“高于”或“低于”),其原因是:_______________
(3)写出元素D基态原子的电子排布式:______________________。
【答案】1 2 三角锥形 低于 Cl2晶体属于分子晶体,Si晶体属于原子晶体,原子晶体中原子之间以很强的共价键结合,而分子晶体中分子间以较弱的分子间作用力结合,因而原子晶体的熔点比分子晶体的熔点高 1s22s22p63s23p63d54s1
【解析】
根据信息A为第三周期中的半导体材料,得出A为Si;B的L层s电子数比p电子数少1,得出B为N;同一周期,元素原子对应的第一电离能有增大的趋势,则根据C在第三周期主族元素中其第一电离能最大,推出该元素为Cl;D在前四周期中其未成对电子数最多,所以为Cr。
A为第三周期中的半导体材料,得出A为Si;B的L层s电子数比p电子数少1,即电子排布式为1s22s22p3,得出B为N元素;C在第三周期主族元素中其第一电离能最大,为Cl;D在前四周期呀中其未成对电子数最多,即M层d能级半满,N层s能级半满,即电子排布式为1s22s22p63s23p63d54s1,所以该元素为Cr。
(1)B单质分子为氮气,分子内为氮氮三键,则含有1个![]() 键和2个
键和2个![]() 键;其气态氢化物为NH3,空间构型为三角锥形,
键;其气态氢化物为NH3,空间构型为三角锥形,
故答案为:1;2;三角锥形;
(2)C单质为Cl2,其晶体类型为分子晶体;A单质为Si,其晶体属于原子晶体,因原子晶体中原子之间以很强的共价键结合,而分子晶体中分子间以较弱的分子间作用力结合,所以C单质(Cl2)的熔点低于A单质(Si)的熔点,
故答案为:低于;Cl2晶体属于分子晶体,Si晶体属于原子晶体,原子晶体中原子之间以很强的共价键结合,而分子晶体中分子间以较弱的分子间作用力结合,因而原子晶体的熔点比分子晶体的熔点高;
(3)D在前四周期中,其未成对电子数最多,即M层d能级半满,N层s能级半满,即其基态原子的电子排布式为1s22s22p63s23p63d54s1,
故答案为:1s22s22p63s23p63d54s1。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案