题目内容
【题目】某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
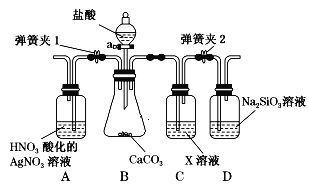
实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭活塞。
请回答:
(1)仪器a的名称:___________________。
(2)通过步骤 Ⅰ、 Ⅱ 得知盐酸具有的性质是________(填字母)。
A.挥发性 B.还原性 C.氧化性 D.酸性
(3)C装置的作用是______________,X是____________________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是________,D中反应的化学方程式是__________。
(5)碳、硅的非金属性逐渐减弱的原因是___________(从原子结构角度加以解释)。
【答案】分液漏斗 A、D 除HCl气体 NaHCO3 打开弹簧夹2,关闭弹簧夹1,当D中出现白色胶状沉淀后 Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3 碳和硅位于同一主族,从上到下,原子半径逐渐增大,得电子的能力减弱,非金属性减弱
【解析】
Ⅰ.打开弹簧夹1,关闭弹簧夹2,打开活塞,滴加盐酸,B中发生盐酸与碳酸钙的反应,生成氯化钙、水、二氧化碳;Ⅱ.关闭弹簧夹1,打开弹簧夹2,当D中出现白色胶状沉淀后,A中看到白色沉淀时,关闭活塞;C装置中X为碳酸氢钠溶液,与挥发的盐酸反应,可除去二氧化碳中混有的HCl;D中发生二氧化碳与硅酸钠溶液的反应。
(1)仪器a的名称是分液漏斗;
答案:分液漏斗
(2)步骤Ⅰ反应CaCO3+2HCl=CaCl2+CO2↑+H2O ,步骤Ⅱ反应AgNO3+HCl=AgCl↓+HNO3,体现了盐酸的酸性和挥发性;
答案:A、D
(3)C装置的作用是除HCl气体,X为碳酸氢钠溶液,与挥发的盐酸反应,可除去二氧化碳中混有的HCl;
答案:除HCl气体 NaHCO3
(4)步骤Ⅱ中未写的操作和现象是关闭弹簧夹1,打开弹簧夹2,当D中出现白色胶状沉淀后,A中看到白色沉淀时,关闭活塞;D中发生二氧化碳与硅酸钠溶液的反应,该反应为Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3;
答案: 打开弹簧夹2,关闭弹簧夹1,当D中出现白色胶状沉淀后 Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3
(5)碳、硅的非金属性逐渐减弱的原因是碳和硅位于同一主族,从上到下,原子半径逐渐增大,得电子的能力减弱,非金属性减弱;
答案:碳和硅位于同一主族,从上到下,原子半径逐渐增大,得电子的能力减弱,非金属性减弱。