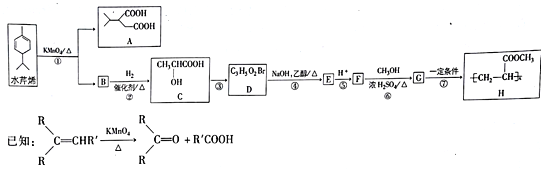
题目内容
【题目】已知α氨基酸在一定条件下能与亚硝酸(HNO2)反应得到α羟基酸。如:![]() +N2↑+H2O,试根据下图所示关系回答下列有关问题。
+N2↑+H2O,试根据下图所示关系回答下列有关问题。

(1)写出A、B的结构简式:
A________________________________________________________________________;
B________________________________________________________________________。
(2)写出C→D的化学方程式:________________________________________。
(3)写出C→E的化学方程式:___________________________________。
【答案】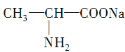
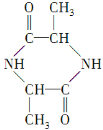
![]()
【解析】
本题主要考查羧酸类物质的性质。
(1)A是丙氨酸钠,B是环二肽,结构简式:A![]() ;B
;B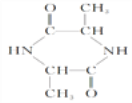 。
。
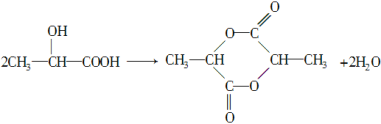
(2)C是α-羟基丙酸,C→D发生两个C分子间的脱水反应,反应的化学方程式为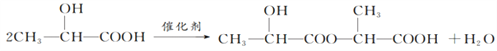 。
。
(3)C→E发生酯化反应,两个C分子之间形成环酯,反应的化学方程式为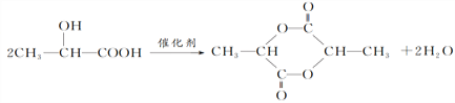 。
。

 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案【题目】一氧化碳、二氧化碳的利用具有十分重要的意义,科学家提出以下几个设想:
Ⅰ.二氧化碳与氢气在催化剂作用下可制取低碳烯烃。
在一恒容密闭容器中分别投入1 molCO2、3molH2,发生反应:2CO2(g)+ 6H2(g)![]() C2H4(g) +4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图。则△H______ 0 (填“>”“<”或“不能确定”)。
C2H4(g) +4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图。则△H______ 0 (填“>”“<”或“不能确定”)。

Ⅱ. 甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如左下图所示。则平衡状态由A变到B时,平衡常数K(A)_____________K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示)。

(2)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如右上图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_____________________。
(3)甲醇是重要的化工原料,可作为燃料。对于上述反应①而言:
(I)若该反应在恒温恒容条件下进行,下列说法正确的是_________;
a.若混合气体的平均摩尔质量不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入氩气使压强增大,平衡向右移动,CO转化率增大
c.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
d.若使用催化剂,会改变反应的途径,反应的焓变减小
(II)某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数 K=50,反应到某时刻测得各组分的物质的量如下:
物质 | CO | H2 | CH3OH |
物质的量/mol | 0.4 | 0.4 | 0.8 |
请比较此时正、逆反应速率的大小:v正 ____v逆(填“>”、“<”或“=”)
(4)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合后,溶液中:2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为________________mol/L。
【题目】下列物质的分类依据正确的是( )
物质类别 | 分类依据 | |
A | 酸 | 电离时能否产生氢离子 |
B | 碱性氧化物 | 是否属于金属氧化物 |
C | 胶体 | 能否发生丁达尔现象 |
D | 强电解质 | 在水溶液中或熔化状态下能否完全电离 |
A. AB. BC. CD. D