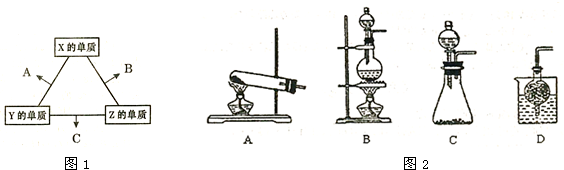
��Ŀ����
��֪��
����ȲΪԭ�ϣ�ͨ����ͼ��ʾ�����ܺϳ��л��м���E��ת�������еķ�Ӧ���������ֲ�������ȥ����

���У�A��B��C��D�ֱ����һ���л��B�Ļ�ѧʽΪC4H10O2��������������ش���������
��1�� A����B�Ļ�ѧ��Ӧ������_____________________��
��2�� д������A�Ļ�ѧ��Ӧ����ʽ____________________��
��3�� B��Ũ������¼��ȣ������ɶ����л����д��2����Է���������AС���л�����Ľṹ��ʽ:_________________��__________________��
��4�� д��C����D�Ļ�ѧ��Ӧ����ʽ��________________________��
��5�����б���������E��Ϊͬ���칹�������_________�֣�д������һ��ͬ���칹��Ľṹ��ʽ��
__________________��
��2�� д������A�Ļ�ѧ��Ӧ����ʽ____________________��
��3�� B��Ũ������¼��ȣ������ɶ����л����д��2����Է���������AС���л�����Ľṹ��ʽ:_________________��__________________��
��4�� д��C����D�Ļ�ѧ��Ӧ����ʽ��________________________��
��5�����б���������E��Ϊͬ���칹�������_________�֣�д������һ��ͬ���칹��Ľṹ��ʽ��
__________________��
��1�� �ӳɷ�Ӧ����ԭ��Ӧ��
��2��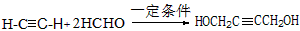
��2��
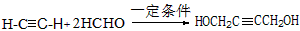
��3��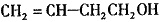 ��
��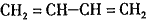 ��
��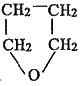 �����������ɣ�
�����������ɣ�
��4��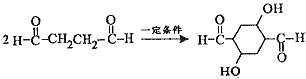
��5��6��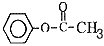 ����
����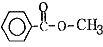 ��
��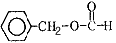 ��
��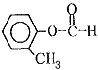 ��
��
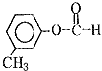 ��
��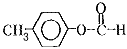 ��
��
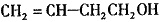 ��
��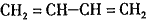 ��
�� �����������ɣ�
�����������ɣ���4��
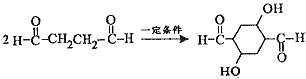
��5��6��
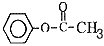 ����
����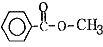 ��
��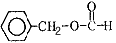 ��
�� ��
�� ��
��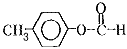 ��
��
��ϰ��ϵ�д�
�����Ŀ
 ����˵����ȷ���ǣ�������
����˵����ȷ���ǣ�������
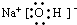
 H++HO2��
H++HO2��