题目内容
【题目】现有含淀粉、NaCl、Na2SO4、CaCl2的混合溶液,选择适当的试剂和方法从中提纯出NaCl晶体.相应的实验过程如图: 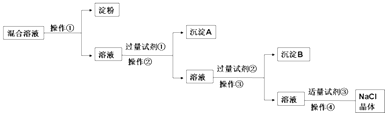
(1)操作①是利用胶体不能通过而把淀粉胶体和溶液进行分离.
(2)写出上述实验过程中所用试剂的化学式:试剂①;试剂③ .
(3)判断试剂①已过量的操作是: .
(4)控制试剂③适量的方法是: .
(5)试剂②的作用(用化学方程式表示): .
【答案】
(1)半透膜
(2)BaCl2;HCl
(3)静置,向上层清液中滴加少量氯化钡溶液,无白色沉淀产生,说明氯化钡溶液已过量
(4)当溶液中不产生气泡时,就可以停止加盐酸
(5)Ba2++CO32﹣=BaCO3↓
【解析】解:(1)淀粉为胶体,粒子直径较大,不能透过半透膜,所以可以把淀粉胶体和溶液进行分离,故答案为:半透膜;(2)由以上分析可知试剂①为BaCl2 , 试剂③为HCl,故答案为:BaCl2;HCl;(3)判断试剂①已过量的方法是静置,向上层清液中滴加少量氯化钡溶液,没有白色沉淀产生,说明氯化钡溶液已过量,
故答案为:静置,向上层清液中滴加少量氯化钡溶液,无白色沉淀产生,说明氯化钡溶液已过量;(4)试剂③为盐酸,加入盐酸可除去过量的Na2CO3 , 同时产生气泡,所以控制试剂③适量的方法是观察溶液中是否有气泡出现,当溶液中不产生气泡时,就可以停止加盐酸,故答案为:当溶液中不产生气泡时,就可以停止加盐酸;(5)试剂②为Na2CO3 , 是用来除去溶液中的钡离子的,反应的离子方程式为Ba2++CO32﹣=BaCO3↓,
故答案为:Ba2++CO32﹣=BaCO3↓.
胶体不能透过半透膜,操作①为渗析,除去Na2SO4、CaCl2 , 可分别加入BaCl2、Na2CO3 , 除去粗盐中含有的Ca2+、SO42﹣可溶性杂质的方法:加入过量BaCl2 , 去除硫酸根离子;再加入过量Na2CO3(去除钙离子),则试剂①为BaCl2 , 操作②为过滤,沉淀A为硫酸钡,试剂②为Na2CO3 , 操作③为过滤,沉淀B为碳酸钙和碳酸钡,试剂③为盐酸,加入盐酸可除去过量的Na2CO3 , 最后蒸发结晶可得到NaCl晶体,以此解答该题.

【题目】2013年9月以来,我国很多地区再大面积出现雾霾,特别是华中华北尤其严重,汽车尾气、燃煤废气和冬季取暖排放的CO2等都是形成雾霾的原因。
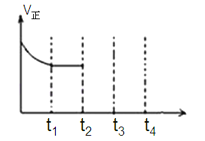
Ⅰ.用于净化汽车尾气的反应为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H<0,在一定温度下,如图在一体积固定的密闭容器中充入一定量的NO和CO,在t1时刻达到平衡状态。
2CO2(g)+N2(g)△H<0,在一定温度下,如图在一体积固定的密闭容器中充入一定量的NO和CO,在t1时刻达到平衡状态。
(1)能判断该反应达到平衡状态的标志是_______。
A.在单位时间内生成1mol CO2的同时消耗了1mol CO
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.混合气体的压强不再变化
(2)在t2时刻将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件.请在图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:___________
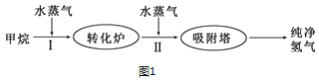
Ⅱ.使用石油热裂解的副产物CH4来制取H2,其生产流程如图1所示:
(3)此流程的第Ⅰ步反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g),一定条件下CH4的平均转化率与温度、压强的关系如图2所示,则P1_____P2(填“>”、“<”或“=”),100℃时,将1molCH4(g)和2molH2O(g)通入容积为100L的恒容的密闭容器中,达到平衡时CH4的转化率为0.5。此时该反应的平衡常数K____________ (写出完整的计算过程)
CO(g)+3H2(g),一定条件下CH4的平均转化率与温度、压强的关系如图2所示,则P1_____P2(填“>”、“<”或“=”),100℃时,将1molCH4(g)和2molH2O(g)通入容积为100L的恒容的密闭容器中,达到平衡时CH4的转化率为0.5。此时该反应的平衡常数K____________ (写出完整的计算过程)
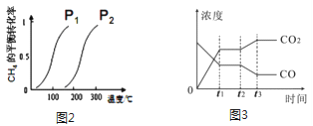
(4)此流程的第Ⅱ步反应的平衡常数随温度的变化情况如下表
温度/℃ | 400 | 500 | 830 |
平衡常数K | 10 | 9 | 1 |
温度/℃ | 400 | 500 | 830 |
平衡常数K | 10 | 9 | 1 |
从表上可以推断该反应是___________(填“吸热”或“放热”)反应,若反应在500℃时进行,设CO(g)和H2O(g)的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时,CO的转化率为________;
(5)图3表反应Ⅱ在t1时达到平衡,在t2时因改变某个条件引起浓度变化的情况,图中t2时改变的条件是降低温度或________________(写一种)
【题目】下列实验设计的步骤及现象均正确的是( )
选项 | 实验目的 | 实验步骤及现象 |
A | 证明氯水有酸性 | 试样 |
B | 检验某红棕色气体是否为溴蒸气 | 试样 |
C | 证明酸性条件下H2O2氧化性比 I2强 | NaI |
D | 比较: Ksp(AgCl)>Ksp(AgI) | AgNO3 溶液 |
A. A B. B C. C D. D