题目内容
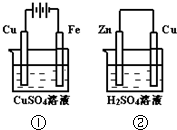
如图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol e一,若不考虑溶液体积的变化,则下列叙述正确的是( )
A.在①中Cu棒为阳极;在②中Cu棒为负极
B.电极上析出物质的质量:①<②
C.电极反应式:①中阳极:4OH--4e-=2H2O+O2↑;②中负极:2H++2e-=H2↑
D.溶液的pH:①不变;②增大
【答案】分析:先判断装置类型,再确定装置中的电极类型;根据电极类型确定电极上发生的反应及溶液中PH值的变化;
解答:解:①有外接电源,所以是电解池;②没有外接电源,所以是原电池.
A、①中铜接正极,所以铜是阳极,铁是阴极;②中锌的活泼性大于铜的,所以锌是负极铜是正极;故A错误.
B、①Cu2++2e-=Cu
2mol 64g
0.02mol 0.64g
所以析出铜 0.64g
②2H++2e-=H2↑
2mol 2g
0.02 mol 0.02g
得到氢气 0.02g,所以①>②,故B错误.
C、电极反应式:①中阳极:Cu-2e-=Cu2+,②中负极:Zn-2e-=Zn2+
故C错误.
D、①中各离子的浓度不变,所以PH 值不变;②中氢离子得电子生成氢气,氢离子的浓度降低,所以PH增大.
故D正确.
故选D.
点评:原电池、电解池的判断方法:
1、若无外加电源,可能是原电池,然后再根据原电池的形成条件判定;
2、若有外加电源,两电极插入电解质溶液中,可能是电解池或电镀池,当阳极金属与电解质溶液中的金属阳离子相同时,则为电镀池.
3、若无明显外接电源的串联电路,则利用题中信息找出能自发进行氧化还原反应的装置为原电池.
解答:解:①有外接电源,所以是电解池;②没有外接电源,所以是原电池.
A、①中铜接正极,所以铜是阳极,铁是阴极;②中锌的活泼性大于铜的,所以锌是负极铜是正极;故A错误.
B、①Cu2++2e-=Cu
2mol 64g
0.02mol 0.64g
所以析出铜 0.64g
②2H++2e-=H2↑
2mol 2g
0.02 mol 0.02g
得到氢气 0.02g,所以①>②,故B错误.
C、电极反应式:①中阳极:Cu-2e-=Cu2+,②中负极:Zn-2e-=Zn2+
故C错误.
D、①中各离子的浓度不变,所以PH 值不变;②中氢离子得电子生成氢气,氢离子的浓度降低,所以PH增大.
故D正确.
故选D.
点评:原电池、电解池的判断方法:
1、若无外加电源,可能是原电池,然后再根据原电池的形成条件判定;
2、若有外加电源,两电极插入电解质溶液中,可能是电解池或电镀池,当阳极金属与电解质溶液中的金属阳离子相同时,则为电镀池.
3、若无明显外接电源的串联电路,则利用题中信息找出能自发进行氧化还原反应的装置为原电池.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 如图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol e一,若不考虑溶液体积的变化,则下列叙述正确的是( )
如图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol e一,若不考虑溶液体积的变化,则下列叙述正确的是( )