题目内容
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是
(3)A、B、C三种元素按原子半径由大到小的顺序排列的为
(4)F的氢化物的电子式
(5)H元素跟A元素形成的化合物的电子式是
(6)C和G两种元素形成的化合物属于
(1)稀有气体化学性质最稳定;同主族自上而下金属性增强,非金属性减弱,同周期随原子序数增大金属性减弱,非金属性增强,故K的金属性增强、Cl的非金属性增强,则KOH碱性最强、高氯酸的酸性最强;
(2)氢氧化铝与氢氧化钠反应生成偏铝酸钠与水;
(3)同主族自上而下原子半径增大,同周期随原子序数增大原子半径减小;
(4)O的氢化物为H2O或H2O2,H2O分子中O原子与H原子之间形成1对共用电子对,H2O2中O原子之间形成1对共用电子对、O原子与H原子之间形成1对共用电子对;
同主族自上而下非金属性减弱,非金属性越强氢化物越稳定;
(5)NaBr属于离子化合物,由钠离子与氯离子构成;
(6)C和G两种元素形成的化合物为MgCl2,属于离子化合物,由镁离子与氯离子构成,用电子式表示形成过程,左边用原子的电子式,右边为氯化镁电子式,用“→”符号连接.
(1)稀有气体Ar的最不活泼;同主族自上而下金属性增强,非金属性减弱,同周期随原子序数增大金属性减弱,非金属性增强,故K的金属性增强、Cl的非金属性增强,则KOH碱性最强,电子式为
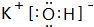 ,HClO4的酸性最强,
,HClO4的酸性最强,故答案为:Ar;K;
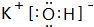 ;HClO4;
;HClO4;(2)氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)同主族自上而下原子半径增大,同周期随原子序数增大原子半径减小,故原子半径K>Na>Mg,
故答案为:K>Na>Mg;
(4)O的氢化物为H2O或H2O2,H2O分子中O原子与H原子之间形成1对共用电子对,其电子式为
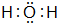 ,H2O2中O原子之间形成1对共用电子对、O原子与H原子之间形成1对共用电子对,其电子式为
,H2O2中O原子之间形成1对共用电子对、O原子与H原子之间形成1对共用电子对,其电子式为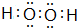 ;
;同主族自上而下非金属性减弱,非金属性越强氢化物越稳定,故氢化物稳定性HCl>HBr,
故答案为:
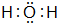 或
或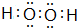 ;HCl>HBr;
;HCl>HBr;(5)NaBr属于离子化合物,由钠离子与氯离子构成,电子式为
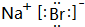 ,故答案为:
,故答案为: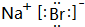 ;
;(6)C和G两种元素形成的化合物为MgCl2,属于离子化合物,用电子式表示其形成过程为:
 ,
,故答案为:离子化合物;
 .
.
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案(13分)下表列出了A—R9种元素在周期表中的位置,用元素符号或化学式填空。
|
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 |
|
|
| E |
| F |
|
|
| 3 | A | C | D |
|
|
| G | R |
| 4 | B |
|
|
|
|
| H |
|
(1)这九种元素中:化学性质最不活泼的是 ;金属性最强的是: 最高价氧化物的水化物碱性最强的碱的电子式是 最高价氧化物的水化物酸性最强的酸是 ;
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是
(2分) 。
(3 )A、B、C三种元素按原子半径由大到小的顺序排列的为 。
(4)F的氢化物的电子式 ;G、H 氢化物的稳定性递减的顺序是: 。
(5)H元素跟A元素形成的化合物的电子式是 。
(6 ) C和G两种元素形成的化合物属于 (填“离子化合物”或“共价化合物”),请用电子式表示其形成过程(2分) 。
(13分)下表列出了A—R9种元素在周期表中的位置,用元素符号或化学式填空。
|
|
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
|
|
|
E |
|
F |
|
|
|
3 |
A |
C |
D |
|
|
|
G |
R |
|
4 |
B |
|
|
|
|
|
H |
|
(1)这九种元素中:化学性质最不活泼的是 ;金属性最强的是: 最高价氧化物的水化物碱性最强的碱的电子式是 最高价氧化物的水化物酸性最强的酸是 ;
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是
(2分) 。
(3 )A、B、C三种元素按原子半径由大到小的顺序排列的为 。
(4)F的氢化物的电子式 ;G、H 氢化物的稳定性递减的顺序是: 。
(5)H元素跟A元素形成的化合物的电子式是 。
(6 ) C和G两种元素形成的化合物属于 (填“离子化合物”或“共价化合物”),请用电子式表示其形成过程(2分) 。
下表列出了A—R9种元素在周期表中的位置,用元素符号或化学式填空。(14分)
|
周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
|
|
|
E |
|
F |
|
|
|
3 |
A[] |
C |
D |
|
|
|
G |
R |
|
4 |
B |
|
|
|
|
|
H |
|
(1)这九种元素中:化学性质最不活泼的是 ;金属性最强的是: 最高价氧化物的水化物碱性最强的碱是 最高价氧化物的水化物酸性最强的酸是 ;
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是
(2分) 。
(3)A、B、C三种元素按原子半径由大到小的顺序排列的为 。
(4)F的氢化物的电子式 ;G、H 氢化物的稳定性递减的顺序是: 。
(5)H元素跟A元素形成的化合物的化学式是 ,该化合物做焰色反应时火焰呈 色。
(6) B和G两种元素形成的化合物属于 (填“离子化合物”或“共价化合物”),请用电子式表示其形成过程(2分) 。
 主族 周期
主族 周期