题目内容
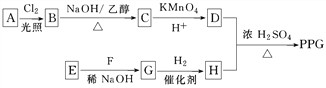
【题目】CoCl2 6H2O可用作油漆干燥剂,工艺上可用含钴废料(主要为Co,含少量Fe、Al等杂质)为原料来制取CoCl2 6H2O,以下是制备该物质的一种新工艺流程:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀 | 2.7 | 7.5 | 7.6 | 3.8 |
完全沉淀 | 3.2 | 9.7 | 9.2 | 5.2 |
请回答下列问题:
(1)“酸浸”时Co转化为Co2+,反应的离子方程式为__________。“酸浸”时不能用硝酸的原因是_______。
(2)“氧化”中欲使3 mol的Fe2+为Fe3+,则需要氧化剂过氧化氢的质量至少为_________g。
(3)加入碳酸钠调节pH至a,a的范围是___________。“滤渣”中所含的两种沉淀的化学式为_________。
(4)滤液中加盐酸的目的是_____________________。
(5)操作I为___________________。
(6)以 CoCl26H2O、NH4Cl、H2O2浓氨水为原料可以制备[Co(NH3)6]Cl3的反应方程式为__________。
【答案】 Co+2H+═Co2++H2↑ 减少有毒气体的排放,防止大气污染;防止产品中混有硝酸盐 51 5.2≤ɑ<7.6 Fe(OH)3、Al(OH)3 调节溶液的pH,抑制钴离子水解 蒸发浓缩,冷却结晶、过滤、洗涤、干燥 2CoCl26H2O+2NH4Cl+10NH3+H2O2═2[Co(NH3)6]Cl3+14H2O
【解析】试题分析:
(1)“酸浸”时Co与盐酸反应生成氯化钴和氢气。金属与硝酸反应放出NO气体。
(2)根据H2O2 + 2Fe2+ +2H+ = 2Fe3+ +2H2O 计算需要双氧水的质量。
(3)加入碳酸钠调节pH至a,让Fe3+、Al3+完全沉淀,Co2+不能沉淀,判断PH范围。
(4) 盐酸能抑制氯化钴水解。
(5)操作I为从溶液中获得晶体的方法。
(6)根据元素守恒配平 CoCl26H2O、NH4Cl、H2O2浓氨水为原料可以制备[Co(NH3)6]Cl3的方程式。
解析:(1)“酸浸”时Co与盐酸反应生成氯化钴和氢气,方程式为Co+2H+═Co2++H2↑。金属与硝酸反应放出NO气体,为减少有毒气体的排放,防止大气污染;防止产品中混有硝酸盐“酸浸”时不能用硝酸。
(2)设需要氧化剂过氧化氢的质量至少为xg
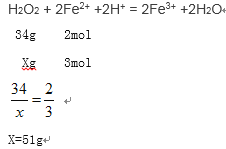
(3)加入碳酸钠调节pH至a,让Fe3+、Al3+完全沉淀PH![]() 5.2,Co2+不能沉淀PH,判断PH<7.6,所以a的范围是5.2≤ɑ<7.6。
5.2,Co2+不能沉淀PH,判断PH<7.6,所以a的范围是5.2≤ɑ<7.6。
(4) 盐酸能抑制氯化钴水解,加入盐酸的目的是调节溶液的pH,抑制钴离子水解。
(5)操作I为蒸发浓缩,冷却结晶、过滤、洗涤、干燥。
(6)根据元素守恒配平 CoCl26H2O、NH4Cl、H2O2浓氨水为原料可以制备[Co(NH3)6]Cl3的方程式为2CoCl26H2O+2NH4Cl+10NH3+H2O2═2[Co(NH3)6]Cl3+14H2O。

【题目】已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:

溶质的物质的量浓度/mol·L-1 | 溶液的密度/g·cm-3 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为__________(不写单位,用含c1、ρ1的代数式表示).
(2)物质的量浓度为c1mol·L-1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为__________mol·L-1.
(3)将物质的量浓度分别为c2mol·L-1和1/5c2mol·L-1的氨水等质量混合,所得溶液的密度__________(填“大于”、“小于”或“等于”,下同) ρ2 g·cm-3;所得溶液的物质的量浓度__________ 3/5c2mol·L-1(设混合后溶液的体积变化忽略不计).
【题目】实验室以蛇纹石酸浸出液(主要含Fe3+,还有一定量的Al3+、Mn2+、Ca2+、Mg2+等)为原料制备高纯氧化铁,流程如下:

已知流程中相关金属离子生成氢氧化物沉淀的pH如下表:
氢氧化物 | Fe3+ | Fe2+ | Al3+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 |
沉淀完全的pH | 3.2 | 8.8 | 5.0 |
(1)“还原”时,应选择_____________(填字母)。
A.Zn粉 B.NaClO溶液 C.Fe粉
(2)“滤渣”的主要成分除含有少量MnF2外,还含有_____________(填化学式)。
(3)“沉锰”时,已知:Ksp(MnS)=4.65×10–14。为确保沉锰完全[即溶液中c(Mn2+)<1.0×10–6 mol·L1],应保持溶液中c(S2-)>_____________mol·L-1。
(4)“除铝”时,控制溶液pH的范围为_____________。
(5)“氧化”时,常用酸性K2Cr2O7溶液检测是否残留未被氧化的金属离子,该反应的离子方程式为_____________。
(6)“沉铁”时,反应温度为85℃条件下,反应时间和反应终点pH对铁的沉淀率的影响分别如下图所示,则最佳的工艺条件是_____________。