题目内容
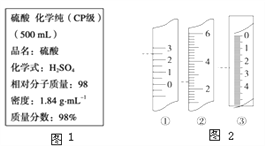
【题目】如图1是盛硫酸的试剂瓶上的标签的部分内容,现实验需要0.5mol·L-1H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室己有的仪器和药品情况回答下列问题:
(1)容量瓶应如何检漏____________________________________。
(2)实验中除量筒、烧杯外还需要的其他仪器________________;
(3)计算所需浓硫酸的体积约为____mL;若将该硫酸与等体积的水混合,所得溶液中溶质的质量分数__________49%(填“<”、“=”或“>”)。
(4)下列操作会引起所配溶液浓度偏大的是_______(填字母)。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.向容量瓶中转移时,溶液未冷却
C.定容时仰视刻度线
D.定容后倒置摇匀后再正立时,发现液面低于刻度线
(5)温度计、量筒、滴定管的一部分如图2所示,下述读数(虚线所指刻度)及说法正确的是_____ (填字母)。
A.①是量筒,读数为2.5mL B.②是量筒,读数为2.5mL
C.③是滴定管,读数为2.5mL D.①是温度计,读数为2.5℃
【答案】 向容量瓶中加水盖上瓶塞倒立,观察是否漏水,然后正立,旋转瓶塞180度,倒立,观察 500mL容量瓶,玻璃棒、胶头滴管 13.6 > AB BD
【解析】试题分析:(1)容量瓶检漏的方法是加适量水后塞紧瓶塞倒置不漏水,然后正放,应注意瓶塞要旋转180度,再倒置看是否漏水;(2)由于没有480mL的容量瓶,故应使用500mL的容量瓶,根据配制过程可知,还缺少500mL容量瓶、玻璃棒、胶头滴管;(3)浓硫酸的物质的量浓度为![]() =18.4mol/L;设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变:V×18.4mol/L=0.5mol/L×0.5L,解得V=0.0136L,即13.6mL;水的密度比硫酸的密度小,等体积混合时,硫酸的质量大于水的质量,所以该硫酸与等体积的水混合所得溶液的质量分数大于49%(4)仰视量筒时,量筒中实际液面高于看到的液面,导致硫酸取多了,结果偏高;未冷却即转移至容量瓶,冷却后液面会低于刻度线,导致浓度偏高,C选项操作引起结果偏低;选项D.定容后倒置摇匀后再正立时,发现液面低于刻度线,由于容量瓶刻度线上方有部分残留溶液,该选项属于正常现象,不影响配制结果,故答案为AB;(5)A.量筒上没有0刻度值,故A错误;B.量筒的读数能够读到0.1mL,图②中液体体积为2.5mL,故B正确;C.滴定管读数时应保留两位小数,正确读数为2.50mL,故C错误;D.只有温度计的0刻度下还有数据,且图示温度为2.5℃,故D正确;故答案为BD。
=18.4mol/L;设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变:V×18.4mol/L=0.5mol/L×0.5L,解得V=0.0136L,即13.6mL;水的密度比硫酸的密度小,等体积混合时,硫酸的质量大于水的质量,所以该硫酸与等体积的水混合所得溶液的质量分数大于49%(4)仰视量筒时,量筒中实际液面高于看到的液面,导致硫酸取多了,结果偏高;未冷却即转移至容量瓶,冷却后液面会低于刻度线,导致浓度偏高,C选项操作引起结果偏低;选项D.定容后倒置摇匀后再正立时,发现液面低于刻度线,由于容量瓶刻度线上方有部分残留溶液,该选项属于正常现象,不影响配制结果,故答案为AB;(5)A.量筒上没有0刻度值,故A错误;B.量筒的读数能够读到0.1mL,图②中液体体积为2.5mL,故B正确;C.滴定管读数时应保留两位小数,正确读数为2.50mL,故C错误;D.只有温度计的0刻度下还有数据,且图示温度为2.5℃,故D正确;故答案为BD。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
