题目内容
【题目】Fe3+与SCN-形成的配离子颜色极似血液,常被用于电影特技和魔术表演。回答下列问题:
(1)画出Fe3+的外围电子排布图:___________;SCN-的结构式为________,SCN-中σ键与π键数目之比为________。
(2)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为_________。硫的一种同素异形体分子式为S8,其结构如右图所示,其中S原子的杂化轨道类型为______。S8易溶于二硫化碳的原因是___________。
![]()
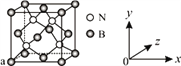
(3)N与B可形成化合物立方氮化硼,其结构与金刚石相似,是超硬材料,立方氮化硼属于________晶体。已知立方氮化硼晶体内存在配位键,则其晶体中配位键与普通共价键数目之比为______。原子坐标参数可表示晶胞内部各原子的相对位置,图中a处B的原子坐标参数为(0, 0, 0),则距离该B原子最近的N原子坐标参数为_________。
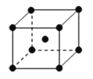
(4)单质铁的晶体结构如右图所示,该堆积方式名称为________。已知该晶胞的密度为ρg/cm3,则铁原子半径的计算式为_________ pm。
(5)磺酰氯(SO2Cl2)和亚硫酰氯(SOCl2)是两种重要试剂。磺酰氯可看成是硫酸分子中2个羟基被氯原子取代后的衍生物,主要用于有机合成;亚硫酰氯可与水剧烈反应,常用于与一些易水解的无机氯化物(MgCl2·6H2O)作用制取无水金属氯化物(MgCl2)。
已知:SO2(g)+Cl2(g)+SCl2(g)![]() 2SOCl2(g) ……(Ⅰ)
2SOCl2(g) ……(Ⅰ)
SO2(g)+Cl2(g)![]() SO2Cl2(g) ………………(Ⅱ)
SO2Cl2(g) ………………(Ⅱ)
回答下列问题:
(a)SO2Cl2的空间构型为_______________。
(b)反应Ⅰ、Ⅱ的化学平衡常数分别为K1、K2,则:SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g)的平衡常数K=_______。
2SOCl2(g)的平衡常数K=_______。
(c)在50L恒容密闭容器中充入1.0molSO2和1.0molCl2发生反应Ⅱ,测得SO2的转化率随时间变化关系如右图所示。

①反应Ⅱ属于________反应(填“放热”“ 吸热”)。在T1温度下,从反应开始至刚好达到平衡时的平均反应速率v(SO2)=___________。为了提高SO2的平衡转化率,除改变温度外,还可以采取的一条措施是__________。
②在T2温度下反应,起始压强为101kPa,则平衡时气体的压强p平=__________kPa。气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),T2温度下,该反应的化学平衡常数Kp=______________。
(d)无水AlCl3在有机合成中应用广泛。蒸干AlCl3溶液不能得到无水AlCl3,用化学方程式表示其原因:______________。工业上常用SOCl2与AlCl3·6H2O混合并加热制备无水AlCl3,原因是__________________。
【答案】 ![]() [S-C≡N]-或[S=C=N]- 1:1 哑铃形 sp3 S8和二硫化碳都是非极性分子,根据相似相溶原理S8易溶于二硫化碳 原子 1:3 (4) (,,) 体心立方堆积
[S-C≡N]-或[S=C=N]- 1:1 哑铃形 sp3 S8和二硫化碳都是非极性分子,根据相似相溶原理S8易溶于二硫化碳 原子 1:3 (4) (,,) 体心立方堆积 ![]() ×
×![]() ×1010 四面体
×1010 四面体 ![]() 放热 3.2×10-3mol/(L·min) 充入氯气、分离产物等 70.7 0.0743(kPa)-1或
放热 3.2×10-3mol/(L·min) 充入氯气、分离产物等 70.7 0.0743(kPa)-1或![]() (kPa)-1
(kPa)-1 ![]() (kPa)-1 AlCl3+3H2O
(kPa)-1 AlCl3+3H2O![]() Al(OH)3+3HCl↑ SOCl2与结晶水反应产生的HCl抑制了AlCl3水解
Al(OH)3+3HCl↑ SOCl2与结晶水反应产生的HCl抑制了AlCl3水解
【解析】(1)铁原子的核电荷数为26,外围电子排布图为3d64s2,Fe3+的外围电子排布图:![]() ;SCN-的结构式为[S-C≡N]-或[S=C=N]-;根据其结构可知:σ键数目为2,π键数为2,数目之比为1:1;正确答案:
;SCN-的结构式为[S-C≡N]-或[S=C=N]-;根据其结构可知:σ键数目为2,π键数为2,数目之比为1:1;正确答案: ![]() ; [S-C≡N]-或[S=C=N]- ; 1:1。
; [S-C≡N]-或[S=C=N]- ; 1:1。
(2)基态硫原子中,核外电子排布1s22s22p63s23p4,核外占据最高能级为p,电子云轮廓图形状为哑铃形;硫的一种同素异形体(结构如图所示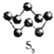 )易溶于
)易溶于![]() ,此硫的同素异形体形成分子晶体,硫原子电子对数为
,此硫的同素异形体形成分子晶体,硫原子电子对数为![]() ,杂化类型为
,杂化类型为![]() ,S8和二硫化碳都是非极性分子,根据相似相溶原理S8易溶于二硫化碳;正确答案:哑铃形; sp3; S8和二硫化碳都是非极性分子,根据相似相溶原理S8易溶于二硫化碳。
,S8和二硫化碳都是非极性分子,根据相似相溶原理S8易溶于二硫化碳;正确答案:哑铃形; sp3; S8和二硫化碳都是非极性分子,根据相似相溶原理S8易溶于二硫化碳。
(3)金刚石为原子晶体,所以氮化硼为原子晶体;则其晶体中配位键与普通共价键数目之比为4:12=1:3;根据坐标B(0,0,0);B(l/2,0,l/2);B(l/2,l/2,0),可知晶胞的边长为1,距离上述三个B原子最近且等距的N原子的坐标参数为(![]() ,
,![]() ,
,![]() );正确答案: 原子;1:3;(,,)。
);正确答案: 原子;1:3;(,,)。
(4)根据晶胞结构可知,铁的晶胞为体心立方堆积;设晶胞的棱长为acm,则晶胞的体积为a3cm3;该晶胞中含有铁原子个数为8×1/8+1=2,所以该晶胞的体积a3=![]() ;晶胞的体对角线为√3a
;晶胞的体对角线为√3a![]() ,铁原子半径为体对角线的
,铁原子半径为体对角线的![]() =
= ![]() ×
×![]() ×1010 pm;正确答案:体心立方堆积;
×1010 pm;正确答案:体心立方堆积;![]() ×
×![]() ×1010 。
×1010 。
(5)(a)SO2Cl2的空间构型为 ,价层电子对个数=孤电子对个数+σ键个数=0+4=4,故S原子采取sp3杂化,结构四面体构型;正确答案:四面体。
,价层电子对个数=孤电子对个数+σ键个数=0+4=4,故S原子采取sp3杂化,结构四面体构型;正确答案:四面体。
(b)SO2(g)+Cl2(g)+SCl2(g)![]() 2SOCl2(g),K1=c2(SOCl2)/c(SCl2)c(Cl2) c(SO2);SO2(g)+Cl2(g)
2SOCl2(g),K1=c2(SOCl2)/c(SCl2)c(Cl2) c(SO2);SO2(g)+Cl2(g)![]() SO2Cl2(g),K2= c(SOCl2)/ c(Cl2) c(SO2);SO2Cl2(g)+SCl(g)2SOCl2(g),K= c2(SOCl2)/ c(SCl2) c(SOCl2) 所以是由(Ⅰ)、(Ⅱ)相除得到,K=K1/K2;正确答案:K1/K2。
SO2Cl2(g),K2= c(SOCl2)/ c(Cl2) c(SO2);SO2Cl2(g)+SCl(g)2SOCl2(g),K= c2(SOCl2)/ c(SCl2) c(SOCl2) 所以是由(Ⅰ)、(Ⅱ)相除得到,K=K1/K2;正确答案:K1/K2。
(c)①根据图像可知,温度T2>T1,温度由T2升高到T1,二氧化硫的转化率增大,反应正向移动,该反应正反应为放热反应;根据反应方程式可知:
SO2(g)+Cl2(g) ![]() SO2Cl2(g)
SO2Cl2(g)
起始量 1 1 0
变化量 0.8 0.8 0.8
平衡量 0.2 0.2 0.8
到平衡时的平均反应速率v(SO2)=0.8/50×5=.3.2×10-3mol/(L·min) 为了提高SO2的平衡转化率,除改变温度外,还可以采取的一条措施增加氯气浓度、减少产物浓度等;正确答案: 放热;3.2×10-3mol/(L·min);充入氯气、分离产物等 。
②根据图像可知,温度为T2时,压强为101kPa,二氧化硫的转化率为60%,据此进行下列计算:
SO2(g)+Cl2(g) ![]() SO2Cl2(g)
SO2Cl2(g)
起始量 1 1 0
变化量 0.6 0.6 0.8
平衡量 0.4 0.4 0.6
平衡分压 2/7 2/7 3/7
根据压强之比等于气体的物质的量之比,所以:2:101=(0.4+0.4+0.6):p平,p平=70.7 kPa;该反应的化学平衡常数Kp=KP(SO2Cl2) p平/ KP(Cl2) p平KP(CSO2) p平= 3/7/ (2/7 p平)2= 0.0743;正确答案:70.7;0.0743(kPa)-1或![]() (kPa)-1 或
(kPa)-1 或![]() (kPa)-1 。
(kPa)-1 。
(d)AlCl3属于强酸弱碱盐,水解显酸性:AlCl3+3H2O![]() Al(OH)3+3HCl↑;SOCl2与结晶水反应生成盐酸,抑制了AlCl3水解;正确答案:SOCl2与结晶水反应产生的HCl抑制了AlCl3水解。
Al(OH)3+3HCl↑;SOCl2与结晶水反应生成盐酸,抑制了AlCl3水解;正确答案:SOCl2与结晶水反应产生的HCl抑制了AlCl3水解。