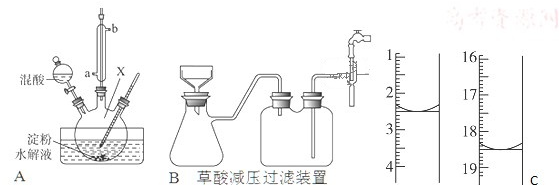
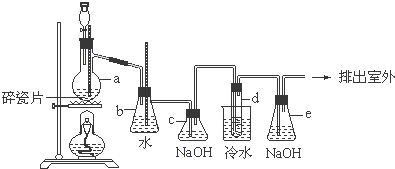
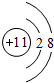题目内容
17.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g),体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)0~2s内用O2来表示的化学反应速率为v(O2)=1.1×10-3mol•L-1•s-1.
(3)已知:K300℃>K350℃,则该反应是放热反应.
(4)能说明该反应已达到平衡状态的是BC.
A.v(NO2)=2v (O2) B.容器内压强保持不变 C.v(逆)(NO)=2v(正)(O2)D.容器内密度保持不变
(5)能使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂.
分析 (1)平衡常数表达式等于生成物的浓度幂之积比上反应物的浓度幂之积;根据平衡转化率K=$\frac{转化了的}{原来的}×100%$来计算;
(2)根据v=$\frac{△c}{△t}$计算v(NO),再利用速率之比等于化学计量数之比计算v(O2);
(3)温度低,化学平衡常数大,则正反应放热;
(4)反应达到平衡的标志是正逆反应速率相同,各成分含量保持不变,反应过程中“变量不变”是分析的依据;
(5)A.及时分离出NO2气体,NO2的浓度减小,据此分析反应速率和平衡的变化;
B.适当升高温度,反应速率加快,正反应放热,据此分析平衡的移动方向;
C.增大O2的浓度,反应速率加快,平衡右移;
D.催化剂不能使平衡移动.
解答 解:(1)平衡常数表达式等于生成物的浓度幂之积比上反应物的浓度幂之积,K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)•c({O}_{2})}$;
平衡转化率K=$\frac{转化了的}{原来的}×100%$=$\frac{0.02mol-0.007mol}{0.02mol}×100%$=65%,
故答案为:K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)•c({O}_{2})}$;65%;
(2)2s内用NO表示的平均反应速率v(NO)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.02mol-0.007mol}{2L}}{3s}$=2.2×10-3mol•L-1•s-1,速率之比等于化学计量数之比,所以v(O2)=$\frac{1}{2}$v(NO)=$\frac{1}{2}$×2.2×10-3mol•L-1•s-1=1.1×10-3mol•L-1•s-1,故答案为:1.1×10-3mol•L-1•s-1
(3)温度低,化学平衡常数大,即降低温度,平衡右移,则正反应放热,故答案为:放;
(4)A.v(SO3)=2v(O2),只是表示了正反应速率之比,无法判断正逆反应速率是否相等,故A错误;
B.反应前后气体体积不同,压强不变说明正逆反应速率相等,各组分浓度不变,故B正确;
C.v逆(NO)=2v正(O2)时,说明一氧化氮正逆反应速率相等,反应达到平衡状态,故C正确;
D.恒容容器,反应物生成物都是气体质量不变,所以密度不变不一定平衡,故D错误;
故选:BC;
(5)2NO(g)+O2(g)═2NO2(g)△H<0,反应是气体体积减小的放热反应,采取下列措施,其中能使该反应的反应速率增大,且平衡向正反应方向移动;
A.及时分离除NO2气体,减少生成物浓度,平衡正向进行,但反应速率减小,故A错误;
B.升高温度,平衡逆向移动,故B错误;
C.增大O2的浓度,化学反应速率加快,平衡正向移动,故C正确;
D.选择高效催化剂,化学反应速率加快,平衡不移动,故D错误,
故答案为:C.
点评 本题考查了化学平衡状态的判断、化学反应速率和化学平衡的影响因素、平衡常数的计算,难度中等.要注意把握平衡状态的特征.

①FeCl2 ②H2SO4 ③NH4NO3 ④FeCl3.
| A. | 只有②③④ | B. | 只有②④ | C. | 只有①③④ | D. | 全部 |
| A. | CH3OH和CH3OCH3 | B. | C6H5OH和C6H5CH2OH | ||
| C. | CH3Cl和C3H7Cl | D. | C17H35COOH和C17H33COOH |
| A. | 黄铜属于合金,硬度比纯铜高 | |
| B. | MgO、Al2O3是耐高温材料,工业上常用其电解冶炼对应的金属 | |
| C. | 与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物 | |
| D. | 金属单质与盐溶液的反应都是置换反应 |
| A. | 标准状况下,22.4 L氦气和1 mol氟气所含原子数均为2NA | |
| B. | 1 mol H2O、1 mol NH3 和1mo l OH-所含电子数均为10NA | |
| C. | 1 mol Na2O2与CO2反应电子转移为2NA | |
| D. | 标准状况下22.4L的氯气和某些物质反应,电子转移一定为2NA |
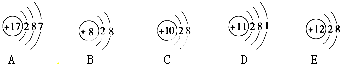
 、
、