题目内容
10.标准状况下,1mol SO2气体与1mol SO3固体具有相同的( )| A. | 体积 | B. | 质量 | C. | 分子数目 | D. | 原子数目 |
分析 标况下三氧化硫是固体,气体摩尔体积对其不适用,根据m=nM、N=nNA及分子构成计算质量、分子数及原子数,据此分析解答.
解答 解:A.标况下,三氧化硫是固体,气体摩尔体积对其不适用,所以无法计算三氧化硫体积,故A错误;
B.根据m=nM知,相同物质的量的二氧化硫和三氧化硫,其质量之比等于其摩尔质量之比=64g/mol:80g/mol=4:5,所以其质量不同,故B错误;
C.根据N=nNA知,分子数与物质的量成正比,物质的量相等,所以其分子数相等,故C正确;
D.二者分子数相等,因为每个二氧化硫、三氧化硫分子数不等,所以总原子个数不等,故D错误;
故选C.
点评 本题考查阿伏伽德罗定律及其推论,明确物质的量的有关公式及公式适用范围及条件是解本题关键,注意标况下三氧化硫是固体而不是气体,易错选项是A.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.向AgCl饱和溶液中加水,下列叙述正确的是( )
| A. | AgCl 的溶解度增大 | B. | AgCl 的溶解度、Ksp均不变 | ||
| C. | AgCl 的Ksp增大 | D. | AgCl 的溶解度、Ksp增大 |
15.已知某溶液中存在较多的H+、SO42-,则该溶液中还可以大量共存的离子组是( )
| A. | Al3+、CO32-、Cl- | B. | Mg2+、Ba2+、Br- | C. | Mg2+、Cl-、HCO3- | D. | Na+、NH4+、Cl- |
2.某学生用NaHCO3和KHCO3组成的某混合物进行试验,测得如下数据(盐酸的物质的量浓度相等):
根据表中数据试计算:
(1)写出混合物与盐酸反应的离子方程式H++HCO-3=H2O+CO2↑.
(2)盐酸的物质的量浓度3mol/L.
(2)实验③中27.6g混合物中NaHCO3的物质的量是0.15mol.
| 实验编号 | ① | ② | ③ |
| 盐酸体积 | 50mL盐酸 | 50mL盐酸 | 50mL盐酸 |
| m(混合物) | 9.2g | 16.56g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
(1)写出混合物与盐酸反应的离子方程式H++HCO-3=H2O+CO2↑.
(2)盐酸的物质的量浓度3mol/L.
(2)实验③中27.6g混合物中NaHCO3的物质的量是0.15mol.
19.合成氨所需的H2由炭和水蒸气反应制得,其中一步反应为CO+H2O(g)?CO2+H2△H<0,欲使CO的转化率提高,同时提高H2的产率,可以采取的措施是( )
| A. | 增大水蒸气的浓度 | B. | 升高温度 | ||
| C. | 增大CO浓度 | D. | 增大压强 |
20.对于反应:M+N-→P,如果温度每升高10℃,化学反应速率提高到原来的3倍,在10℃时完成反应的10%需要81min,将温度提高到30℃时,完成反应的10%需要的时间为( )
| A. | 9 min | B. | 27 min | C. | 13.5 min | D. | 3 min |
 在一密闭容器中充入适量的反应物A和B发生反应:aA(g)+bB(g)?dD(g)+eE(g)△H,随着反应的进行,不断升高温度,产物D的百分含量随温度的变化如图所示.回答下列问题:
在一密闭容器中充入适量的反应物A和B发生反应:aA(g)+bB(g)?dD(g)+eE(g)△H,随着反应的进行,不断升高温度,产物D的百分含量随温度的变化如图所示.回答下列问题: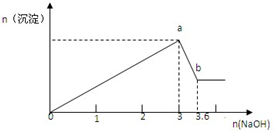 现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图,请计算出
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图,请计算出