题目内容
【题目】如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是

A. X极是电源负极,Y极是电源正极
B. 电解过程中CuSO4溶液的pH逐渐增大
C. a极的电极反应是2Cl--2e-=Cl2↑
D. Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
【答案】C
【解析】A、a、b是石墨电极,通电一段时间后,b极附近溶液显红色,依据电解质溶液为氯化钠的酚酞溶液,判断b电极是阴极,氢离子放电,氢氧根浓度增大,则Y为电源负极,X为电源正极,A错误;B、电解过程中CuSO4溶液中的氢氧根离子在阳极Pt电极失电子生成氧气,溶液中铜离子在Cu电极得到电子析出铜,溶液中氢离子浓度增大,溶液的pH逐渐减小,B错误;C、a电极是阳极,溶液中的氯离子失电子发生氧化反应,电极反应为2Cl--2e-=Cl2↑,C正确;D、电解过程中CuSO4溶液中的氢氧根离子在阳极Pt电极失电子生成氧气,溶液中铜离子在Cu电极得到电子析出铜,D错误;答案选C。

【题目】化学反应是化学实验现象的本质,根据描述回答下列问题:
(1)在BaCl2溶液中通入SO2气体,未见沉淀生成,若先通入或加入下列的另一种物质,再通入SO2不能看到沉淀的有 (填序号).
①Cl2②NaOH③HCl④FeCl3溶液⑤CO2⑥H2S⑦NH3⑧NaClO溶液
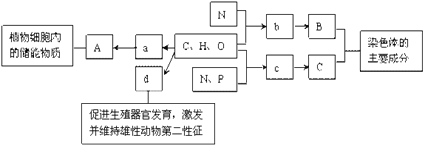
(2)图中A、B、C之间有以下的转化关系(副产物已略去);
![]()
则下列说法正确的是
a.若A是非金属单质,则C与水反应的生成物可能是强酸或弱酸
b.若A是金属单质,则C与水反应的生成物可能是强碱
c.若A是化合物,则C与水反应的生成物可能是强酸
(3)离子方程式是重要的化学用语.下列是有关离子方程式的一些错误观点,请在下列表格相应的“离子方程式”否定这些观点.
反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuSO4
错误观点 | “否定的”离子方程式 | |
① | 所有的离子方程式均可以表示一类化学反应 |
|
② | 所有酸碱中和反应均可表示为 H++OH﹣═H2O |
|