题目内容
 硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.
硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.
(1)钒触媒(V2O5)能加快SO2的氧化速率,此过程中SO2先与V2O5反应生成V2O4.该过程的化学方程式可表示为______.
(2)为测定过程中混合气的SO2体积分数,选用0.0500mol/LI2的标准溶液、淀粉溶液进行测定.已知:V(耗用I2标准溶液)=10.00mL,V(采集烟气)=100.0mL(已折算为标准状况),则烟气中SO2的体积分数为______.
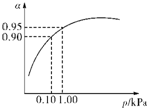
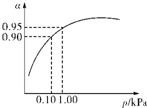
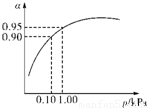
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示.试分析工业生产中采用常压的原因是______.
(4)在温度相同、体积均为1L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下.
已知:2SO2(g)+O2(g)?2SO3(g);△H=-98.3kJ?mol-1.
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2molSO2、1molO2 | 2molSO3 | mmolSO2、nmolO2、pmolSO3 |
| c(SO3)/mol?L-1 | 1.4 | 1.4 | 1.4 |
| 能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| SO2或SO3的转化率 | α1 | α2 | 12.5% |
解:(1)SO2先与V2O5反应生成V2O4,V2O5参与反应作氧化剂,本身被还原为V2O4则二氧化硫被氧化为三氧化硫,
故答案为:SO2+V2O5?V2O4+SO3;
(2)根据公式n=c×v,I2的物质的量为n=0.0500mol/L×0.01L=5×10-4mol,根据反应:
SO2 +I2 +2H2O=H2SO4+2HI
5×10-4mol 5×10-4mol
标准状况下的体积为5×10-4mol×22.4L/mol=1.12×10-2L.V(采集烟气)=100.0mL(已折算为标准状况),则烟气中SO2的体积分数为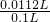 =0.112.故答案为:0.112;
=0.112.故答案为:0.112;
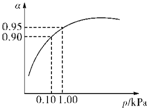
(3)当压强为0.1KPa时,SO2的转化率为0.90,SO2的转化率已很高,当压强为1.0KPa时,SO2的转化率为0.95;
此时,对设备、能源都有很高的要求,压强的增加引起SO2转化率的变化并不明显,经济上不划算,
故答案为:在常压时,SO2的转化率已很高,若加压,则对设备、能源等有较高的要求,经济上不划算;
(4)在温度相同、体积均为1L的三个密闭容器中,SO3的物质的量均为1mol.化学平衡状态的达到与化学反应途径无关.在相同的条件下,可逆反应,无论从正反应开始还是从逆反应开始,还是从既有反应物又有生成物开始,达到的化学平衡状态是相同的,平衡混合物中各组成物质的百分含量保持不变,就是等效平衡.三个密闭容器,保持恒温、恒容,最终c(SO3)=1.4 mol?L-1.三个容器中的反应为等效平衡.体积均为1L,最终n(SO3)=1.4 mol.
甲 2SO2(g)+O2(g)?2SO3(g);△H=-98.3kJ?mol-1.
起始量(mol) 2 1 0
变化量 (mol) 1.4 0.7 1.4-98.3kJ× =68.81KJ
=68.81KJ
平衡量 (mol) 0.6 0.3
故a=68.81,α1=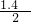 =0.7,
=0.7,
乙容器保持恒温、恒容,和甲容器中反应为等效平衡.故b=98.3kJ×(2-1.4)/2=29.49kJ.该反应从三氧化硫开始,α2=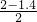 =0.3,α1+α2=0.7+0.3=1.
=0.3,α1+α2=0.7+0.3=1.
丙 2SO2(g)+O2(g)?2SO3(g);△H=-98.3kJ?mol-1.吸收ckJ说明反应从逆反应方向开始.
起始量(mol) m n p
变化量 (mol) 0.2 0.1 1.4÷(1-12.5%)-1.4
平衡量 (mol) m+0.2 n+0.1 1.4
P=1.4÷(1-12.5%)=1.6,c=98.3kJ×(1.6-1.4)/2=9.83
b+c=29.49+9.83=39.32kJ,
故答案为:1;1.6;39.32.
分析:(1)根据钒触媒(V2O5)能加快SO2的氧化速率,此过程中SO2先与V2O5反应生成V2O4,可看出钒元素的化合价从+5价降为+4价,所以,二氧化硫中的硫从+4价上升为+5价;
(2)碘单质具有氧化性,二氧化硫中+4价的硫具有还原性,发生反应:SO2+I2+2H2O=H2SO4+2HI;
(3)从图象中可以看出,当压强为0.1KPa时,SO2的转化率为0.90,当压强为1.0KPa时,SO2的转化率为0.95;
(4)2SO2(g)+O2(g)?2SO3(g);△H=-98.3kJ?mol-1,该反应为放热反应,恒温、恒容,放出的能量以及转化率与参加反应的物质的物质的量成正比.
点评:本题考查了硫酸的工业制取的生产原理应用.解题时需注意利用信息进行判断和书写化学方程式.该题还需掌握化学平衡的计算的基本方法.
故答案为:SO2+V2O5?V2O4+SO3;
(2)根据公式n=c×v,I2的物质的量为n=0.0500mol/L×0.01L=5×10-4mol,根据反应:
SO2 +I2 +2H2O=H2SO4+2HI
5×10-4mol 5×10-4mol
标准状况下的体积为5×10-4mol×22.4L/mol=1.12×10-2L.V(采集烟气)=100.0mL(已折算为标准状况),则烟气中SO2的体积分数为
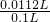 =0.112.故答案为:0.112;
=0.112.故答案为:0.112;(3)当压强为0.1KPa时,SO2的转化率为0.90,SO2的转化率已很高,当压强为1.0KPa时,SO2的转化率为0.95;
此时,对设备、能源都有很高的要求,压强的增加引起SO2转化率的变化并不明显,经济上不划算,
故答案为:在常压时,SO2的转化率已很高,若加压,则对设备、能源等有较高的要求,经济上不划算;
(4)在温度相同、体积均为1L的三个密闭容器中,SO3的物质的量均为1mol.化学平衡状态的达到与化学反应途径无关.在相同的条件下,可逆反应,无论从正反应开始还是从逆反应开始,还是从既有反应物又有生成物开始,达到的化学平衡状态是相同的,平衡混合物中各组成物质的百分含量保持不变,就是等效平衡.三个密闭容器,保持恒温、恒容,最终c(SO3)=1.4 mol?L-1.三个容器中的反应为等效平衡.体积均为1L,最终n(SO3)=1.4 mol.
甲 2SO2(g)+O2(g)?2SO3(g);△H=-98.3kJ?mol-1.
起始量(mol) 2 1 0
变化量 (mol) 1.4 0.7 1.4-98.3kJ×
 =68.81KJ
=68.81KJ 平衡量 (mol) 0.6 0.3
故a=68.81,α1=
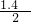 =0.7,
=0.7,乙容器保持恒温、恒容,和甲容器中反应为等效平衡.故b=98.3kJ×(2-1.4)/2=29.49kJ.该反应从三氧化硫开始,α2=
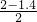 =0.3,α1+α2=0.7+0.3=1.
=0.3,α1+α2=0.7+0.3=1.丙 2SO2(g)+O2(g)?2SO3(g);△H=-98.3kJ?mol-1.吸收ckJ说明反应从逆反应方向开始.
起始量(mol) m n p
变化量 (mol) 0.2 0.1 1.4÷(1-12.5%)-1.4
平衡量 (mol) m+0.2 n+0.1 1.4
P=1.4÷(1-12.5%)=1.6,c=98.3kJ×(1.6-1.4)/2=9.83
b+c=29.49+9.83=39.32kJ,
故答案为:1;1.6;39.32.
分析:(1)根据钒触媒(V2O5)能加快SO2的氧化速率,此过程中SO2先与V2O5反应生成V2O4,可看出钒元素的化合价从+5价降为+4价,所以,二氧化硫中的硫从+4价上升为+5价;
(2)碘单质具有氧化性,二氧化硫中+4价的硫具有还原性,发生反应:SO2+I2+2H2O=H2SO4+2HI;
(3)从图象中可以看出,当压强为0.1KPa时,SO2的转化率为0.90,当压强为1.0KPa时,SO2的转化率为0.95;
(4)2SO2(g)+O2(g)?2SO3(g);△H=-98.3kJ?mol-1,该反应为放热反应,恒温、恒容,放出的能量以及转化率与参加反应的物质的物质的量成正比.
点评:本题考查了硫酸的工业制取的生产原理应用.解题时需注意利用信息进行判断和书写化学方程式.该题还需掌握化学平衡的计算的基本方法.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.
(1)钒触媒(V2O5)能加快SO2的氧化速率,此过程中SO2先与V2O5反应生成V2O4.该过程的化学方程式可表示为______.
(2)为测定过程中混合气的SO2体积分数,选用0.0500mol/LI2的标准溶液、淀粉溶液进行测定.已知:V(耗用I2标准溶液)=10.00mL,V(采集烟气)=100.0mL(已折算为标准状况),则烟气中SO2的体积分数为______.
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示.试分析工业生产中采用常压的原因是______.
(4)在温度相同、体积均为1L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下.
已知:2SO2(g)+O2(g)?2SO3(g);△H=-98.3kJ?mol-1.
则α1+α2=______,p=______mol,b+c=______kJ.
(1)钒触媒(V2O5)能加快SO2的氧化速率,此过程中SO2先与V2O5反应生成V2O4.该过程的化学方程式可表示为______.
(2)为测定过程中混合气的SO2体积分数,选用0.0500mol/LI2的标准溶液、淀粉溶液进行测定.已知:V(耗用I2标准溶液)=10.00mL,V(采集烟气)=100.0mL(已折算为标准状况),则烟气中SO2的体积分数为______.
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示.试分析工业生产中采用常压的原因是______.
(4)在温度相同、体积均为1L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下.
已知:2SO2(g)+O2(g)?2SO3(g);△H=-98.3kJ?mol-1.
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2molSO2、1molO2 | 2molSO3 | mmolSO2、nmolO2、pmolSO3 |
| c(SO3)/mol?L-1 | 1.4 | 1.4 | 1.4 |
| 能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| SO2或SO3的转化率 | α1 | α2 | 12.5% |

 硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.
硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.