题目内容
【题目】【化学——选修物质结构与性质】
X是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y基态原子的3p轨道上有2个未成对电子。元素Z 的原子最外层电子数是其内层的3倍。回答下列问题:
(1)元素X在元素周期表中位于 区,单质X的晶体类型为 ,其中X原子的配位数为 。
(2)已知元素Y可与元素Z的相对原子质量只差为16,则元素Y基态原子的外围电子排布图为 ,其同周期元素中,第一电离能最大的是________________(写元素符号)。元素Y的含氧酸中,酸性最强的是_____________(写化学式),该酸根离子的立体构型为_____________。
(3)Z的氢化物在乙醇中的溶解度大于Y的氢化物,其原因是 。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
(5)X与Y形成的一种化合物的立方晶胞如图所示。
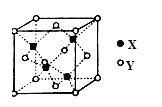
该化合物的化学式为_______________,已知此晶体的密度为ρg·cm–3,阿伏伽德罗常数为NA,则此晶胞中X与Y的最近距离是 cm。(写出计算式,不要求计算结果。)
【答案】(1)ds;金属晶体;12
(2)![]() ;Ar;H2SO4;正四面体形
;Ar;H2SO4;正四面体形
(3)水分子与乙醇分子间可形成氢键,而硫化氢不能,所以硫化氢在乙醇中的溶解度小于水的溶解度
(4)16NA(5)ZnS ![]()
【解析】
试题分析:元素X 位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为2,所以该原子有30个电子,为Zn元素;元素Y基态原子的3p轨道上有2个未成对电子,则Y是S或Si元素,结合题中与Zn形成的晶胞结构可知,在晶胞中X离子数为8×1/8+6×1/2=4,Y离子数为4,所以X、Y的个数比为1:1,可推得Y为S元素;元素Z的原子最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,所以Z是O元素。
(1)由以上分析可知,X为Zn元素,在元素周期表中位于ds区,单质X的晶体类型为金属晶体,属于面心立方结构。X原子的配位数为12。故答案为:ds;金属晶体;12;
(2)已知元素Y可与元素Z的相对原子质量只差为16,则元素Y为硫元素,其基态原子的外围电子排布图为![]() ;其同周期元素中,第一电离能最大的是Ar。元素Y的含氧酸中,酸性最强的是H2SO4;SO42-的立体构型为正四面体形。
;其同周期元素中,第一电离能最大的是Ar。元素Y的含氧酸中,酸性最强的是H2SO4;SO42-的立体构型为正四面体形。
(3)Z的氢化物是水、Y的氢化物是硫化氢,由于水分子与乙醇分子间能形成氢键,而硫化氢不能,所以水在乙醇中的溶解度大于硫化氢。故答案为:水分子与乙醇分子间可形成氢键,而硫化氢不能,所以硫化氢在乙醇中的溶解度小于水的溶解度;
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,该化合物中N-H键及配位键均是σ键,1mol该配合物中含有σ键的数目为16。
(5)由上述分析可知,该化合物的化学式为ZnS,且每个晶胞中含有4个ZnS。已知此晶体的密度为ρg·cm–3,阿伏伽德罗常数为NA,设晶胞的边长为a,则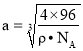 ,再根据晶胞中Zn原子与S原子之间最短距离为对角线的1/4,而对角线为
,再根据晶胞中Zn原子与S原子之间最短距离为对角线的1/4,而对角线为![]() ,所以Zn原子与S原子之间最短距离为
,所以Zn原子与S原子之间最短距离为![]() 。
。