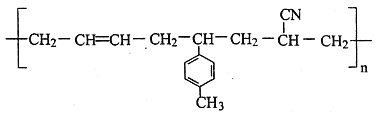
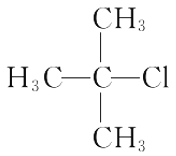
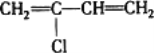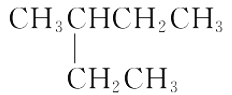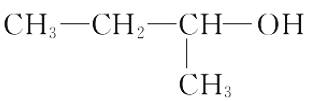题目内容
【题目】A~H八种短周期主族元素在周期表中的相对位置如图所示,已知C元素形成的单质有“国防金属”的美誉,E的最高化合价与最低化合价之和为2。回答下列问题:
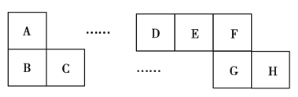
(1)D元素在周期表中的位置为___。
(2)B、E、F的简单离子半径由大到小的顺序为__(用离子符号表示)。
(3)上述元素所形成的气态单质中能用于饮用水消毒的有__(填化学式)。
(4)B的单质在F的单质中燃烧的火焰颜色为__。
(5)C元素的单质可以在D和F形成的一种气态化合物中燃烧,写出该反应的化学方程式:__。
【答案】第2周期ⅣA族 N3->O2->Na+ Cl2、O3 黄色 2Mg+CO2![]() 2MgO+C
2MgO+C
【解析】
根据元素在周期表中的位置及元素性质分析元素的种类;根据元素周期律及元素性质分析解答。
C的单质为“国防金属”,因此C为![]() ,以此为突破口可推知A为
,以此为突破口可推知A为![]() ,B为
,B为![]() ;由“E的最高化合价与最低化合价之和为2”可知E为
;由“E的最高化合价与最低化合价之和为2”可知E为![]() ,故D为C,F为
,故D为C,F为![]() ,G为
,G为![]() ,H为
,H为![]() 。则
。则
(1)碳在元素周期表中位于第2周期ⅣA族,故答案为:第2周期ⅣA族;
(2)电子层结构相同的微粒,核电荷数越大,离子半径越小,故离子半径:![]() ,故答案为:N3->O2->Na+;
,故答案为:N3->O2->Na+;
(3)Cl2溶解于水生成![]() ,能杀菌消毒;O3具有强氧化性,能杀菌消毒,故答案为:Cl2、O3;
,能杀菌消毒;O3具有强氧化性,能杀菌消毒,故答案为:Cl2、O3;
(4)Na在氧气中燃烧产生黄色火焰,故答案为:黄色;
(5)镁在二氧化碳中燃烧生成氧化镁和碳,化学方程式为:2Mg+CO2![]() 2MgO+C,故答案为:2Mg+CO2
2MgO+C,故答案为:2Mg+CO2![]() 2MgO+C。
2MgO+C。

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作 | 结论 |
A | 向甲苯中滴加少量高锰酸钾溶液,高锰酸钾溶液褪色 | 甲苯发生了氧化反应 |
B | 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液,有沉淀生成 | 蛋白质发生了变性 |
C | 向某溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀 | 该溶液中含有 |
D | 向淀粉溶液中加入稀硫酸,加热几分钟,冷却后再加入新制的Cu(OH)2悬浊液,加热,没有观察到砖红色沉淀 | 淀粉没有水解 |
A.AB.BC.CD.D
【题目】在2 L密闭容器中,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=________,已知:K(300℃)>K(350℃),该反应是________反应(填“放热”或“吸热”)。
(2)下图中表示NO2的变化的曲线是___,用O2的浓度变化表示从0~2 s内该反应的平均速率v=__________。

(3)能说明该反应已经达到平衡状态的是(____)
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是(____)
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂