题目内容
物质的量浓度为0.05 mol·L-1的稀硫酸A mL,加入一定体积的BaCl2溶液后,恰好完全沉淀,此时溶液的体积为100 mL,溶液中H+物质的量浓度为0.01 mol·L-1,求BaCl2溶液的物质的量浓度(忽略混合时引起溶液体积的变化)。
0.005 6 mol·L-1
0.05 mol·L-1的H2SO4中H+浓度为0.1 mol·L-1。H2SO4与BaCl2反应后,H+物质的量不变,而浓度变成0.01 mol·L-1,说明原稀硫酸被冲稀了10倍。反应后溶液为100 mL,在忽略混合时溶液体积变化的情况下,原稀硫酸溶液的体积为10 mL,BaCl2溶液的体积为90 mL。
BaCl2 + H2SO4====BaSO4↓+2HCl
1 mol 1 mol
n(BaCl2) 0.05 mol·L-1×0.01
n(BaCl2)=0.000 5 mol
c(BaCl2)=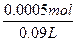 ="0.005" 6 mol·L-1
="0.005" 6 mol·L-1
BaCl2 + H2SO4====BaSO4↓+2HCl
1 mol 1 mol
n(BaCl2) 0.05 mol·L-1×0.01
n(BaCl2)=0.000 5 mol
c(BaCl2)=
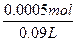 ="0.005" 6 mol·L-1
="0.005" 6 mol·L-1
练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
 的物质的量浓度最接近于( )
的物质的量浓度最接近于( )