题目内容
已知有五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族;A与B形成的离子化合物A2B中所有的离子的电子数都相同,其电子总数为30;D和E可形成4核10电子分子。试回答下列问题:
1. 写出下列元素的名称:A ,B
2. 写出D元素的原子结构示意图 ,C元素在周期表中的位置 。
3. 写出下列物质的电子式
E与B形成的化合物:
A、B、E形成的化合物:
D、E形成的化合物:
4. 写出C的最高价氧化物对应水化物的浓溶液与铜反应的化学方程式
写出D的最高价氧化物对应水化物的稀溶液与铜反应的离子方程式
1. 写出下列元素的名称:A ,B
2. 写出D元素的原子结构示意图 ,C元素在周期表中的位置 。
3. 写出下列物质的电子式
E与B形成的化合物:
A、B、E形成的化合物:
D、E形成的化合物:
4. 写出C的最高价氧化物对应水化物的浓溶液与铜反应的化学方程式
写出D的最高价氧化物对应水化物的稀溶液与铜反应的离子方程式
(本题共11分,前3小题每个问题各1分,第4小题各个方程式2分)
1、A 钠 ,B 氧 2、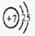 ,第三周期ⅥA族
,第三周期ⅥA族
3、 ( 或
( 或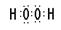 ) 、
) 、 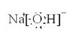 、
、 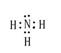
4、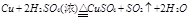 、
、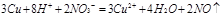
(不注明浓、不写明条件、不配平均不给分)
1、A 钠 ,B 氧 2、
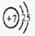 ,第三周期ⅥA族
,第三周期ⅥA族3、
 ( 或
( 或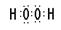 ) 、
) 、 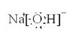 、
、 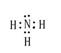
4、
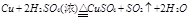 、
、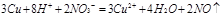
(不注明浓、不写明条件、不配平均不给分)
试题分析:(1)A与B形成的离子化合物A2B中所有的离子的电子数都相同,其电子总数为30,所以A是Na,B是O。又因为原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族,所以C是S。D和E可形成4核10电子分子,因此D是N,E是H。
(2)氮元素的原子序数是7,其原子结构示意图为
 ;S的原子序数是16,位于第三周期ⅥA族。
;S的原子序数是16,位于第三周期ⅥA族。(3)H和O可以形成水和双氧水,都是共价化合物,其电子式分别是
 、
、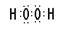 ;A、B、E形成的化合物是氢氧化钠,含有离子键和极性键,电子式是
;A、B、E形成的化合物是氢氧化钠,含有离子键和极性键,电子式是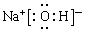 ;D、E形成的化合物是氨气,含有极性键,电子式是
;D、E形成的化合物是氨气,含有极性键,电子式是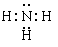 。
。(4)C的最高价氧化物对应水化物是硫酸,浓硫酸具有氧化性,和铜反应的方程式是2H2SO4(浓)+Cu
 CuSO4+2H2O+SO2↑;D的最高价氧化物对应水化物是硝酸,硝酸也具有氧化性,和铜反应的离子方程式是3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑。
CuSO4+2H2O+SO2↑;D的最高价氧化物对应水化物是硝酸,硝酸也具有氧化性,和铜反应的离子方程式是3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑。点评:本题属于位、构、性的综合考查,需要熟练掌握元素周期表的结构,然后结合已知的条件逐一推断即可。

练习册系列答案
相关题目
 的含量。关于
的含量。关于
 ,下列叙述判断正确的是( )
,下列叙述判断正确的是( )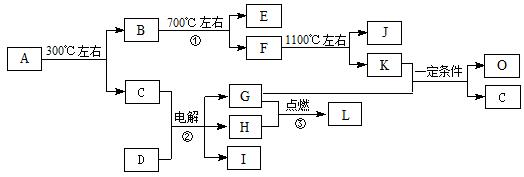
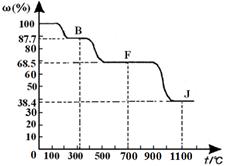
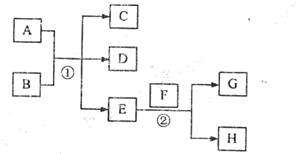
 于C、D之间,B、C、D中均含有钾元素,写出常温时①的离子方程式: 。
于C、D之间,B、C、D中均含有钾元素,写出常温时①的离子方程式: 。 B+H能放出大量的热,该反应曾应用于铁轨的焊接;
B+H能放出大量的热,该反应曾应用于铁轨的焊接; 2F+D,F中E元素的质量分数为60%。
2F+D,F中E元素的质量分数为60%。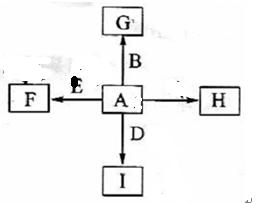
 ;
;