题目内容
热激活电池可用作火箭、导弹的工作电源。其基本结构如图所示,作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池的总反应方程式为:
PbSO4+2LiCl+Ca CaCl2+Li2SO4+Pb。下列有关说法正确的是( )
CaCl2+Li2SO4+Pb。下列有关说法正确的是( )
A.正极反应式:Ca+2Cl--2e- CaCl2 CaCl2 |
| B.常温时,在正负极间接上电流表或检流计,指针不偏转 |
| C.放电过程中,Li+向负极移动 |
| D.每转移0.1 mol电子,理论上生成20.7 g Pb |
B
解析试题分析:该电池钙作负极,硫酸铅作正极。负极反应式是:Ca─2e-=Ca2+。正极的电极式是: PbSO4+2e-=Pb+SO42-。混合物受热熔融后,电池即可瞬间输出电能。所以在常温下在正负极间接上电流表或检流计,指针不偏转。在PbSO4+2LiCl+Ca CaCl2+Li2SO4+Pb中产生1mol的铅即207g,转移电子2mol.所以理论上生成20.7 g Pb,转移0.2 mol电子。选项为:B。
CaCl2+Li2SO4+Pb中产生1mol的铅即207g,转移电子2mol.所以理论上生成20.7 g Pb,转移0.2 mol电子。选项为:B。
考点:考查原电池反应原理及应用的知识。

下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
| 选项 | X | Y |
| A. | MgSO4 | CuSO4 |
| B. | AgNO3 | Pb(NO3)2 |
| C. | FeSO4 | Al2 (SO4)3 |
| D. | CuSO4 | AgNO3 |
理论上不能设计为原电池的化学反应是( )
| A.CH4(g)+2O2(g)=CO2(g)+2H2O(1);△H<0 |
| B.HNO3(1)+NaOH(1)=NaNO3(1)+H2O(1);△H<0 |
| C.2H2(g)+O2(g)=2H2O(1);△H<0 |
| D.2FeCl3(1)+Fe(s)=3FeCl2(1);△H<0 |
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示, 则下列 有关说法中不正确的是( )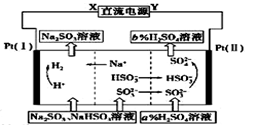
| A.X为直流电源的负极,Y为直流电源的正极 |
| B.阳极区pH增大 |
| C.图中的b>a |
| D.该过程中的产品主要为H2SO4和H2 |
要在铁制品上镀上一定厚度的锌层,以下设计方案正确的是( )
| A.锌作阳极,铁制品作阴极,溶液含有锌离子 |
| B.铂作阴极,铁制品作阳极,溶液含有锌离子 |
| C.铁作阳极,铁制品作阴极,溶液含有亚铁离子 |
| D.锌用阴极,铁制品作阳极,溶液含有锌离子 |
全钒液流电池是一种新型的绿色环保储能电池,该电池性能优良,其电池总反应为:V3++VO2++H2O VO2++2H++V2+。下列叙述正确的是 ( )
VO2++2H++V2+。下列叙述正确的是 ( )
| A.充电时阳极附近溶液的酸性减弱 |
| B.充电时阳极反应式为:VO2++2H++e-=VO2++H2O |
| C.放电过程中电解质溶液中阳离子移向负极 |
| D.放电时每转移1mol电子,负极有1mol V2+被氧化 |
实验发现,在FeCl3酸性溶液中加入少量锌粉后,Fe3+立即被还原成Fe2+。某化学兴趣小组根据该实验事实设计了如图所示的原电池装置。下列有关说法中正确的是( )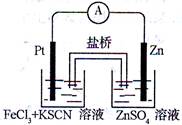
| A.该原电池的正极反应是:Zn-2e— =Zn2+ |
| B.Pt电极表面生成大量气泡 |
| C.左烧杯中溶液的红色逐渐褪去 |
| D.生成的Fe2+通过盐桥可以和锌直接反应生成Fe |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2+H2O+2e—→Mn2O3+2OH— |
| C.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g[ |
| D.电池工作时,电子由负极通过电解液流向正极 |
 从右向左移动。下列分析正确的是
从右向左移动。下列分析正确的是
