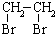题目内容
8.下列叙述中,正确的是(设NA代表阿伏加德罗常数的数值)( )| A. | 1 mol Na2O2固体与1 mol NaHSO4晶体中所含的阴、阳离子总数均为3NA | |
| B. | 由两种元素形成的化合物分子内可能含有非极性键 | |
| C. | 只有非金属元素能形成含氧酸或含氧酸盐 | |
| D. | 最外层有2个电子的原子都是金属原子 |
分析 A、过氧化钠是钠离子和过氧根离子构成,硫酸氢钠固体是钠离子和硫酸氢根离子构成;
B、同种元素形成的共价键为非极性键;
C、金属也可以写成含氧酸或含氧酸盐;
D、氦原子最外层2个电子.
解答 解:A、过氧化钠是钠离子和过氧根离子构成,晶体中所含的阴、阳离子总数均为3NA,硫酸氢钠固体是钠离子和硫酸氢根离子构成,晶体中所含的阴、阳离子总数均为2NA,故A错误;
B、同种元素形成的共价键为非极性键,如H2O2由两种元素形成的化合物,分子内含有O-O非极性键,故B正确;
C、金属也可以写成含氧酸或含氧酸盐,如HMnO4,NaAlO2,故C错误;
D、氦原子最外层2个电子,最外层有2个电子的原子不都是金属原子,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是物质组成和结构的分析判断,掌握基础是关键,题目较简单.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
19.下列物质中与钠、苛性钠、小苏打均能发生反应的是( )
| A. | 乙醇 | B. | 苯酚 | C. | 乙酸 | D. | 乙醛 |
16.在一定体积的密闭容器中通入amolNO和bmolO2,反应后容器内氮原子个数与氧原子个数之比为( )
| A. | $\frac{a}{b}$ | B. | $\frac{a}{a+b}$ | C. | $\frac{a}{a+2b}$ | D. | $\frac{a}{2a+b}$ |
3.下列物质中,属于新型无机非金属材料的是( )
| A. | 有色玻璃 | B. | 碳化硅陶瓷 | C. | 石英玻璃 | D. | 钢化玻璃 |
13.充分燃烧某液态芳香烃X,并收集产生的全部水,恢复到室温时,得到水的质量跟原芳香烃X的质量相等.则X的分子式为( )
| A. | C10H16 | B. | C11H14 | C. | C12H18 | D. | C13H20 |
20.下列离子方程式正确的是( )
| A. | 双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 用铜作电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| D. | 氯化钠与浓硫酸混合加热:H2SO4+2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+Cl2↑+H2O |
18.下列说法正确的是( )
| A. | C5H12的同分异构体数目与甲苯(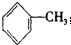 一氯代物的数目相同 一氯代物的数目相同 | |
| B. | CH2═CH2+H20 $\stackrel{一定条件}{→}$CH3CH2OH 属于还原反应 | |
| C. | C3H6Cl2有4种同分异构体(不考虑立体异构) | |
| D. | 石油分馏和煤的干馏均属于物理变化. |
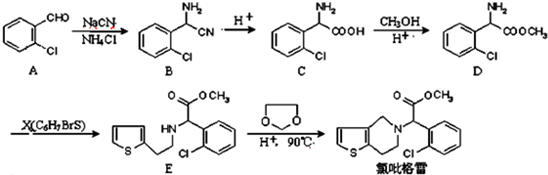
 .
. .
. ②
②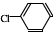 中氯原子较难水解物质A(
中氯原子较难水解物质A(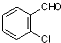 )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式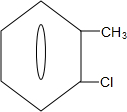 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$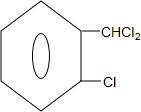 +2HCl;
+2HCl;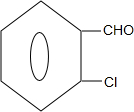 +2NaCl+2H2O
+2NaCl+2H2O
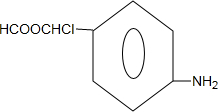
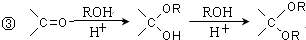
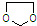 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$