题目内容
【题目】碳及其含碳化合物在人们的生产生活中应用广泛。
(1)将不同量的CO2(g)和H2(g)分别通入到体积为2L的恒容密闭容器中,进行反应2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g),得到如表三组数据;
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
CO2 | H2 | H2 | C2H5OH | |||
1 | 650 | 2 | 6.8 | 2.0 | 0.8 | 6 |
2 | 900 | 2 | 4.4 | 2.0 | 0.4 | 3 |
3 | 900 | 4 | 8.8 | C | d | t |
①实验1中以v(H2)表示的反应速率为________________
②已知在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数称之为化学平衡常数。900℃化学平衡常数为______________,
③如果改变影响平衡的条件之一(如温度,压强,反应物的浓度)平衡将向着能够减弱这种改变的方向移动。则第3组与第2组相比CO2的转化率___________(填“增大”“减小”“不变” 不能确定).
(2)将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒). 持续通入甲烷,在标准状况下,消耗甲烷体积VL.
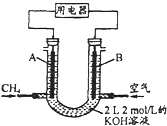
①0<V![]() 44.8L时,负极电极反应为_________________
44.8L时,负极电极反应为_________________
②44.8L<V![]() 89.6L时,电池总反应方程式为_____________
89.6L时,电池总反应方程式为_____________
【答案】 0.4mol/(L.min) 0.12 增大 CH48e+10OH=CO32+7H2O CH4+2O2+K2CO3=2KHCO3+H2O
【解析】(1)①实验1中6min到达平衡,平衡时消耗氢气为(6.8-2)mol=4.8mol,v(H2)=  =0.4mol/(L.min);
=0.4mol/(L.min);
②900℃平衡时氢气为2mol、乙醇为0.4mol,则:
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g)
CH3CH2OH(g)+3H2O(g)
起始量(mol):2 4.4 0 0
变化量(mol):0.8 2.4 0.4 1.2
平衡量(mol):1.2 2 0.4 1.2
900℃平衡常数K=![]() =0.12;
=0.12;
③第3组等效为第2组平衡的基础上增大压强,平衡正向移动,CO2的转化率增大;
(2)①n(KOH)=2mol/L×1L=2mol,该装置是燃料电池,负极上甲烷失电子发生氧化反应,正极上氧气得电子发生还原反应,根据原子守恒得0<n(CO2)≤1mol,二氧化碳不足量,则反应生成碳酸钾,电池总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,负极电极反应为CH48e+10OH=CO32+7H2O;
②根据原子守恒得2mol<n(CO2)≤4mol,反应生成碳酸氢钾,负极反应式为CH4-8e-+9CO32-+3H2O=10HCO3-,总反应式为CH4+2O2+K2CO3=2KHCO3+H2O。

 阅读快车系列答案
阅读快车系列答案