题目内容
【题目】25℃时,水的电离达到平衡: ![]() ,下列叙述正确的是
,下列叙述正确的是
A. 将水加热,Kw增大,pH不变
B. 向水中加入少量盐酸,c(H+)增大,Kw不变
C. 向水中加入NaOH固体,平衡逆向移动,c(OH-)降低
D. 向水中加入AlCl3固体,平衡正向移动,c(OH-)增大
【答案】B
【解析】A、温度升高,水的离子积常数KW增大,则pH值减小,选项A错误;B、向水中加入少量盐酸,c(H+)增大,温度不变Kw不变,选项B正确;C、固体NaOH溶于水电离产生OH - 对水的电离起到抑制作用,电离平衡逆向移动,但c(OH-)增大,选项C错误;D、向水中加入AlCl3固体,Al3+水解促进水的电离,平衡正向移动,水解呈酸性c(OH-)降低,选项D错误。答案选B。

 步步高达标卷系列答案
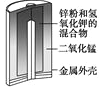
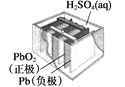
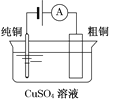
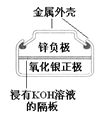
步步高达标卷系列答案【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅-硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A. 图Ⅰ所示电池中,MnO2的作用是催化剂
B. 图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
【题目】酸碱反应是生产生活实际中常见的反应之一。
(1)室温下,向一定量的稀醋酸溶液中逐滴加入等物质的量浓度的氢氧化钠溶液,直至氢氧化钠溶液过量。
①在滴加过程中,稀醋酸溶液中水的电离程度__________(填“增大”、“减小” “不变”、“先增大后减小”或“先减小后增大”);
②在下表中,分别讨论了上述实验过程中离子浓度的大小顺序,对应溶质的化学式和溶液的pH。试填写表中空白:
离子浓度的关系 | 溶质的化学式 | 溶液的pH | |
A | c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | ___________ | pH<7 |
B | c(Na+)= c(CH3COO-) | CH3COONa、CH3COOH | ___________ |
C | ___________ | CH3COONa | pH>7 |
D | c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | ___________ | pH>7 |
(2)室温下,用0.100 mol·L-1的NaOH溶液分别滴定均为20.00 mL 0.100 mol·L-1的HA溶液和醋酸溶液,滴定曲线如图所示。

①HA和醋酸的酸的强弱为:HA______ CH3COOH(填“强于”、“弱于”)
②当pH=7时,两份溶液中c(A-)_____c(CH3COO-)(填“>”、“=”、“<”)
(3)①请设计实验证明醋酸是弱酸______________________________________________。
②请通过计算证明:含等物质的量的CH3COOH和CH3COONa的混合溶液显酸性_____________________________________________________________(已知CH3COOH :Ka=1.8×10-5;KW=1×10-14)。