题目内容
1.下列各组物质的晶体中,所含化学键类型相同、晶体类型也相同的是( )| A. | CO2和SiO2 | B. | NaCl和NH4Cl | C. | CCl4和SiCl4 | D. | 金刚石和C60 |
分析 根据晶体的类型和所含化学键的类型分析,离子化合物含有离子键,可能含有共价键,共价化合物只含共价键,双原子分子或多原子分子含有共价键.
解答 解:A、固体CO2是分子晶体,二氧化硅是原子晶体,二氧化硅、二氧化碳都只含共价键,故A错误;
B、NaCl和NH4Cl都是离子晶体,NaCl中只含离子键,NH4Cl中含有离子键和共价键,故B错误;
C、CCl4和SiCl4都是分子晶体,CCl4和SiCl4都只含共价键,故C正确;
D、金刚石是原子晶体,C60是分子晶体,晶体不同,故D错误,
故选:C.
点评 本题考察了化学键类型和晶体类型的关系.判断依据为:离子晶体中阴阳离子以离子键结合,原子晶体中原子以共价键结合,分子晶体中分子之间以范德华力结合,分子内部存在化学键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了一系列实验,实验结果记录如下
试根据表中的实验现象回答下列问题:
(1)实验1、2中Al所做的电极(正极或负极)不相同(填“相同”或“不同”).
(2)对实验3完成下列填空
①铝为负极,电极反应式:2Al-6e-═2Al3+.
②石墨为正极,电极反应式:6H++6e-═3H2↑.
(3)实验4中铝作负极,理由是Al失去电子,写出铝电极的电极反应式Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素自发的氧化还原反应中金属铝是否参与反应,金属铝参加反应,失电子作负极,反之作正极.
| 编号 | 电极材料 | 电解质溶液 | 电液计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1、2中Al所做的电极(正极或负极)不相同(填“相同”或“不同”).
(2)对实验3完成下列填空
①铝为负极,电极反应式:2Al-6e-═2Al3+.
②石墨为正极,电极反应式:6H++6e-═3H2↑.
(3)实验4中铝作负极,理由是Al失去电子,写出铝电极的电极反应式Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素自发的氧化还原反应中金属铝是否参与反应,金属铝参加反应,失电子作负极,反之作正极.
16.下列说法中正确的是( )
| A. | 用单位体积的溶剂中所含溶质的物质的量来表示溶液组成的物理量叫溶质的物质的量浓度 | |
| B. | 常温常压下,氢气分子和氧气分子本身的大小对于气体体积影响可以忽略不计 | |
| C. | 不同的气体,若体积不同,则它们所含的分子数一定不同 | |
| D. | 气体摩尔体积是指1mol任何气体所占的体积约为22.4L |
6.下列变化过程中表示的能量转化关系错误的是( )
| A. | 金属镁燃烧:化学能→热能和光能 | B. | 原电池:化学能→电能 | ||
| C. | 植物的光合作用:太阳能→热能 | D. | 太阳能热水器:光能→热能 |
13.飞船内安装盛有Na2O2的装置,它的用途是产生氧气.下列关于Na2O2的叙述正确的是( )
| A. | Na2O2中阴、阳离子的个数比为1:1 | |
| B. | Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等 | |
| C. | Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等 | |
| D. | Na2O2的漂白原理与SO2的漂白原理相同 |
10.在氧化钕(Nd2O3)等稀土催化剂的作用下可发生反应:4CO+2NO2═N2+4CO2,若该反应的反应速率分别用v(CO)、v(NO2)、v(N2)、v(CO2)表示,则下列关系正确的是( )
| A. | $\frac{1}{2}$v(CO)=v(NO2) | B. | $\frac{1}{2}$v(NO2)=v(CO2) | C. | $\frac{1}{4}$v(N2)=v(CO2) | D. | $\frac{1}{4}$v(N2)=v(CO) |
11.设NA 表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,0.1 mol Cl2 溶于水,转移的电子数目为0.2NA | |
| B. | 标准状况下,33.6L SO3中含有硫原子的数目为1.5NA | |
| C. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目小于0.6NA |
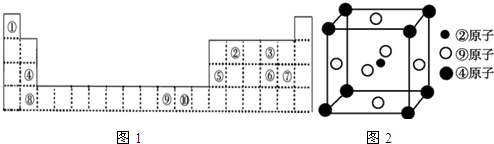
 ;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有硫酸铜水溶液的试管里,现象为开始生成蓝色沉淀,后蓝色沉淀溶解,得到深蓝色的透明溶液.
;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有硫酸铜水溶液的试管里,现象为开始生成蓝色沉淀,后蓝色沉淀溶解,得到深蓝色的透明溶液.