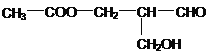
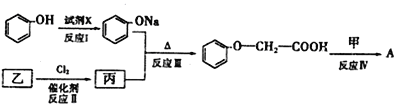
��Ŀ����
����Ŀ���ܼ��仯����㷺Ӧ���ڴ��Բ��ϡ���ز��ϼ���Ӳ���ϵ�����һ���Ʊ������ܾ���(CoC2O4��2H2O)�Ĺ����������£�

��֪����ˮ�ܿ���Ҫ�ɷ�ΪCo2O3��Co(OH)3������������Fe2O3��Al2O3��MnO�����ʡ�
�ڽ���Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Al3+�ȡ�
�۲���������������������ʽ����ʱ��Һ��pH���±�:
(��������Ũ����0.01mol��L-1��)
������ | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
��ʼ����pH | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
��ȫ����pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1) д������������Co(OH)3������Ӧ�����ӷ���ʽ��____________________��
(2) NaClO3��������_______________________��
(3) ��Na2CO3��pH�ķ�ΧӦ����_____֮�䡣������ȡ����Ŀ����____________��
(4) �ڿ����м���5.49g�����ܾ��壨CoC2O4��2H2O����Ʒ�����ȹ����в�ͬ�¶ȷ�Χ�ڷֱ�õ�һ�ֹ������ʣ����������±�:
�¶ȷ�Χ/�� | ��������/g |
150��210 | 4.41 |
290��320 | 2.41 |
890��920 | 2.25 |
���ⶨ��210��290������в���������ֻ��CO2���˹��̷�����Ӧ�Ļ�ѧ����ʽ��____________________��[M(CoC2O4��2H2O=183g/mol]
���𰸡� 2Co(OH)3��SO32-��4H+===2Co2+��SO42-��5H2O ��Fe2+������Fe3+ 5.2~7.6 ��ȥMn2+ 3CoC2O4 + 2O2![]() Co3O4 +6CO2
Co3O4 +6CO2
��������(1) ����������Co(OH)3����������������Na2SO3��������Ӧ�����ӷ���ʽΪ2Co(OH)3��SO32-��4H+=2Co2+��SO42-��5H2O��
(2) Ϊ������Fe2+�ij�ȥ��ʹ��NaClO3��Fe2+������Fe3+��
(3) Ϊ����Fe3+��Al3+��ȫ������ͬʱCo2+����������Na2CO3��pH�ķ�ΧӦ����5.2~7.6֮�䣻������ͼ��֪��������ȡ����Ŀ���dz�ȥMn2+��
(4) �������ʵ���n=![]() =0.03mol��ʧȥ�ᾧˮӦΪ0.06mol�����������仯=0.06mol��18g/mol=1.08g��ͼ�����ݿ�֪��150��210���������仯=5.49g-4.41g=1.08g��˵��210��Cʧȥ�ᾧˮ�õ�CoC2O4��210��290���������CoC2O4�����ķ�Ӧ������������ֻ��CO2 ������Ԫ���غ�õ�����CO2���ʵ���Ϊ0.06mol������=0.06mol��44g/mol=2.64g�������������Ƽ�С=4.41g-2.41g=2g��˵��������μӷ�ӦӦΪ��������Ӧ����������=2.64g-2g=0.64g��O2���ʵ���=
=0.03mol��ʧȥ�ᾧˮӦΪ0.06mol�����������仯=0.06mol��18g/mol=1.08g��ͼ�����ݿ�֪��150��210���������仯=5.49g-4.41g=1.08g��˵��210��Cʧȥ�ᾧˮ�õ�CoC2O4��210��290���������CoC2O4�����ķ�Ӧ������������ֻ��CO2 ������Ԫ���غ�õ�����CO2���ʵ���Ϊ0.06mol������=0.06mol��44g/mol=2.64g�������������Ƽ�С=4.41g-2.41g=2g��˵��������μӷ�ӦӦΪ��������Ӧ����������=2.64g-2g=0.64g��O2���ʵ���=![]() =0.02mol��n(CoC2O4)��n(O2)��n(CO2)=0.03��0.02��0.06=3��2��6������ԭ���غ���ƽ��д��Ӧ�Ļ�ѧ����ʽΪ3CoC2O4+2O2
=0.02mol��n(CoC2O4)��n(O2)��n(CO2)=0.03��0.02��0.06=3��2��6������ԭ���غ���ƽ��д��Ӧ�Ļ�ѧ����ʽΪ3CoC2O4+2O2![]() Co3O4+6CO2��
Co3O4+6CO2��

 ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�