题目内容
设NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.常温常压下,4.6g NO2或N2O4气体中所含原子总数均为0.3NA |
| B.标准状况下,22.4 mL Br2所含的分子数为0.001NA |
| C.标准状况下,22.4L的Cl2与1molFe充分反应,转移的电子数为3NA |
| D.100 mL0.1mol?L-1的H2SO3溶液中,H+总数为0.02 NA |
A
解析试题分析:NO2或N2O4的最简式为NO2,式量为46,所以4.6g含有NO20.1mol,原子的物质的量0.3NA。正确。B.标准状况下, Br2是液体,不能使用气体摩尔体积。错误。C.标准状况下,22.4L的Cl2的物质的量为1mol,所以与1molFe充分反应,转移的电子数为2NA.错误。D.H2SO3是弱酸。所以在100 mL0.1mol?L-1的H2SO3溶液中,H+总数小于0.02 NA。错误。
考点:考查阿伏加德罗常数的应该金属的知识。

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
下列变化中,不需要破坏化学键的是
| A.三氧化硫溶于水 | B.次氯酸见光分解 | C.蔗糖溶于水 | D.氧气变成臭氧 |
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是
| A.Na2O、Na2O2组成元素相同,推出与水反应产物也完全相同 |
| B.SO2和湿润的Cl2都有漂白性,推出二者混合后漂白性更强 |
| C.H2CO3的酸性比HClO强,推出CO2通入NaClO溶液中能生成HClO |
| D.根据常温下铜与浓硝酸可以制取NO2,推出常温下铁与浓硝酸也可以制取NO2 |
下列有关化学用语的使用正确的是
A.HCl的电子式: |
B.镁的原子结构示意图: |
C.溴化钠的电子式:  |
| D.Na2SO4的电离方程式:Na2SO4=Na++ SO42- |
有关化学用语正确的是 ( )
| A.溴乙烷的分子式C2H5Br |
| B.乙醇的结构简式C2H6O |
C.四氯化碳的电子式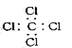 |
| D.乙烯的结构简式CH2CH2 |
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,如附图所示流程处理,下列说法中,正确的是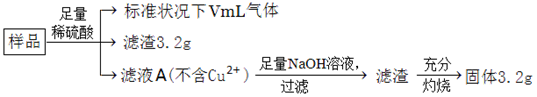
| A.滤液A中阳离子为Fe2+、H+ |
| B.样品中金属Fe的质量为2.14g |
| C.样品中CuO的质量为4.0g |
| D.V=448 |
设NA表示阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,0. 1 mol Cl2溶于水,转移的电子数目为0. 1NA |
| B.常温常压下,18 g H2O 中含有的原子总数为3NA |
| C.标准状况下,11. 2 L CH3CH2OH 中含有的分子数目为0. 5NA |
| D.常温常压下,2. 24 L CO 和CO2混合气体中含有的碳原子数目为0. 1NA |
用NA表示阿伏伽德罗常数的值。下列叙述中不正确的是
| A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| B.28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA |
| C.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA |
| D.常温常压下,22.4L氯气于足量的镁粉反应,转移的电子数为2NA |
在硫酸铝、硫酸钾和明矾的混合溶液中,如果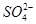 的浓度为0.2 mol·L-1,当加入等体积0.2 mol·L-1KOH溶液时,生成的沉淀恰好完全溶解,(忽略溶液中少量的H+和OH-)则反应后混合溶液中K+的浓度约是
的浓度为0.2 mol·L-1,当加入等体积0.2 mol·L-1KOH溶液时,生成的沉淀恰好完全溶解,(忽略溶液中少量的H+和OH-)则反应后混合溶液中K+的浓度约是
| A.0.125 mol·L-1 | B.0.225 mol·L-1 |
| C.0.250 mol·L-1 | D.0.450 mol·L-1 |