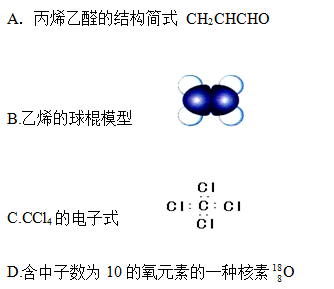
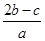题目内容
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,如附图所示流程处理,下列说法中,正确的是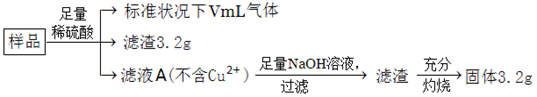
| A.滤液A中阳离子为Fe2+、H+ |
| B.样品中金属Fe的质量为2.14g |
| C.样品中CuO的质量为4.0g |
| D.V=448 |
AD
解析试题分析:A、生成的滤渣3.2g是铜,金属铜可以和三价铁反应,所以一定不含有+3价铁离子,硫酸过量含有氢离子,故A正确;B、固体为三氧化二铁,其物质的量为3.2g÷160g/mol=0.02mol,铁元素的量为0.02mol×2=0.04mol,质量为:0.04mol×56g/mol=2.24g,故B错误;C、根据B的答案知道铁元素质量=2.24g,而原来固体才5.76g,所以CuO质量不超过5.76-2.24=3.52g,故C错误;D、根据最后溶液中溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.04mol,说明参加反应硫酸物质的量为0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,由于合金中氧物质的量(5.76?3.2?2.24)g÷16g/mol=0.02mol,它结合氢离子0.04mol,所以硫酸中有0.08-0.04=0.04molH+生成氢气,即生成0.02mol氢气,标况体积为448ml,故D正确,答案选AD。
考点:考查金属铁、铜及其氧化物与稀硫酸反应的有关计算

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
下列化学用语不能正确解释相关事实的是
A.碱性氢氧燃料电池的正极反应:H2 - 2e- + 2OH-="==" 2H2O  | B.用电子式表示NaCl的形成过程: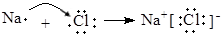 催化剂 |
| C.向含有Hg2+的废水中加入Na2S可除去Hg2+:Hg2+ + S2- ="==" HgS↓ | D.汽车尾气系统的催化转化器可降低NO等的排放:2CO+ 2NO ="==" 2CO2 +N2 |
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
| A.SO2和SiO2 | B.CO2和H2 | C.NaCl和HCl | D.CCl4和KCl |
设NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.常温常压下,4.6g NO2或N2O4气体中所含原子总数均为0.3NA |
| B.标准状况下,22.4 mL Br2所含的分子数为0.001NA |
| C.标准状况下,22.4L的Cl2与1molFe充分反应,转移的电子数为3NA |
| D.100 mL0.1mol?L-1的H2SO3溶液中,H+总数为0.02 NA |
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A.常温下,9g H2O中含NA个O–H键 |
| B.1 molFe2+与足量稀硝酸反应,转移3 NA个电子 |
| C.常温常压下,22. 4L SO2和O2的混合气体中含2NA个氧原子 |
| D.0. 1 mol·L–1KAl(SO4)2溶液中含0.2NA个SO42- |
设NA为阿伏加德罗常数,下列叙述中正确的是
| A.同温同压下,原子数均为NA的氢气和氦气具有相同的体积 |
| B.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为3NA |
C.常温常压下,1mol甲基(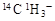 )所含的中子数和电子数分别为8NA、9NA )所含的中子数和电子数分别为8NA、9NA |
| D.在密闭容器中加入28g N2和6g H2,在高温、高压、催化剂的条件下充分反应,生成NH3的分子数为2NA |
下列叙述正确的是
| A.1 mol·L-1NaCl溶液含有NA个Na+ |
| B.10 mL质量分数为98%的H2SO4用水稀释至100 mL,H2SO4的质量分数应大于9.8% |
| C.配制240 mL 1 mol·L-1的NaOH溶液需称NaOH固体的质量为9.6 g |
| D.配制1 mol·L-1的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 |