题目内容
由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性条件下可以产生Cl2。下列关于混盐CaOCl2的有关判断不正确的是( )A.该混盐与硫酸反应产生1 mol Cl2时转移2NA个电子
B.该混盐的水溶液呈碱性
C.该混盐具有较强的氧化性
D.该混盐中氯元素的化合价为+1和-1
A
【解析】 本题考查卤素化合物性质对新信息的学习能力与分析能力。混盐是由两种酸根形成的盐,那么CaOCl2中两种酸根应为ClO-、Cl-,因此该盐就相当于次氯酸钙、氯化钙。在酸性条件下反应的离子方程式为:ClO-+Cl-+2H+====Cl2![]() +H2O,则生成1 mol氯气转移的电子数应为NA错;由于次氯酸钙为弱酸强碱盐(氢氧化钙虽是微溶物,但属于中强碱),水解呈碱性,B正确;该混盐中含有次氯酸根,具有较强的氧化性,C正确;D项正确。
+H2O,则生成1 mol氯气转移的电子数应为NA错;由于次氯酸钙为弱酸强碱盐(氢氧化钙虽是微溶物,但属于中强碱),水解呈碱性,B正确;该混盐中含有次氯酸根,具有较强的氧化性,C正确;D项正确。

练习册系列答案
相关题目
人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。我们目前中学课本中的酸碱理论是1887年阿仑尼乌斯(Arrhenius)提出了的电离理论。
(1)1905年富兰克林(Franklin)把阿仑尼乌斯以水为溶剂的个别现象,推到任何溶剂,提出了酸碱溶剂理论。溶剂理论认为:凡能离解而产生溶剂正离子的物质为酸,凡能离解而产生溶剂负离子的物质为碱。试写出五氯化磷在某条件下自身电离的方程式:
▲ (一种为正四面体阳离子,另一种为正八面体阴离子)。
(2)1923年丹麦化学家布朗斯物(Brφusted)和英国化学家劳莱(Lowry)提出了质子论。凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。按质子理论:下列粒子在水溶液既可看作酸又可看作碱的是 ▲ 。
| A.HSO3- | B.NH4+ | C.OH- | D.HCO3- E.CH3COO- F.Cl- |
酸(电子对接受体) 碱(电子对给予体) 反应产物
H+ + [∶OH ]—
 H∶OH
H∶OH试指出下列两个反应中的酸或碱
①H3BO3 + H2O = H+ + B(OH)4- 该反应中的碱是 ▲ (填:H3BO3或 H2O)
②BF3 + NH3 = BF3· NH3 该反应中的酸是 ▲ (填:BF3 或 NH3)
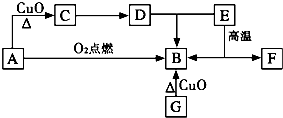 A是生活中最常见的有机物,该化合物的蒸气对氢气的相对密度是23,是生物燃料之一.C的溶液能发生银镜反应,反应后的溶液经酸化可得D.G为单质,其原子最外层电子数为次外层的2倍.F中阴阳离子个数比为1:1,其阳离子与Ar具有相同的电子层结构,A-F的转化关系如图.?
A是生活中最常见的有机物,该化合物的蒸气对氢气的相对密度是23,是生物燃料之一.C的溶液能发生银镜反应,反应后的溶液经酸化可得D.G为单质,其原子最外层电子数为次外层的2倍.F中阴阳离子个数比为1:1,其阳离子与Ar具有相同的电子层结构,A-F的转化关系如图.? H∶OH
H∶OH