题目内容
【题目】高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:
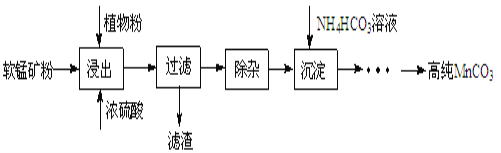
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时,植物粉的作用是_____。
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是_____;
操作②中加入双氧水不仅能将Fe2+氧化为Fe3+,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式_____。
(3)制备:在30℃~35℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀。温度控制35℃以下的原因是_____;该反应的化学方程式为_____;生成的MnCO3沉淀需经充分洗涤,洗涤的操作方法是_____。
(4)计算:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO3)=2.6×10-5,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。___________________
【答案】 作还原剂 增加MnCO3的产量或不引入新的杂质 MnO2+H2O2+2H+=Mn2++2H2O+O2↑ 减少碳酸氢铵的分解,提高原料利用率 MnSO4+2NH4HCO3![]() MnCO3+(NH4)2SO4+CO2↑+H2O 用玻璃棒引流向漏斗中加蒸馏水至刚好浸没沉淀,待水自然流下后,重复操作2-3次 Ksp(MnCO3)=c(Mn2+)c(CO32-),当Mn2+沉淀完全时,c(CO32-)=1.8×10-11/1.0×10-5=1.8×10-6molL-1,若Mg2+也能形成沉淀,则要求Mg2+>2.6×10-5/1.8×10-6=14.4 molL-1,Mg2+的浓度0.01mol/L远小于14.4 molL-1,若净化液中的c(Mg2+)=10-2mol/L,说明Mg2+的存在不会影响MnCO3的纯度)=
MnCO3+(NH4)2SO4+CO2↑+H2O 用玻璃棒引流向漏斗中加蒸馏水至刚好浸没沉淀,待水自然流下后,重复操作2-3次 Ksp(MnCO3)=c(Mn2+)c(CO32-),当Mn2+沉淀完全时,c(CO32-)=1.8×10-11/1.0×10-5=1.8×10-6molL-1,若Mg2+也能形成沉淀,则要求Mg2+>2.6×10-5/1.8×10-6=14.4 molL-1,Mg2+的浓度0.01mol/L远小于14.4 molL-1,若净化液中的c(Mg2+)=10-2mol/L,说明Mg2+的存在不会影响MnCO3的纯度)=
【解析】湿法浸出软锰矿(主要成分为![]() ,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰,加入浓硫酸和植物粉浸出过滤得到滤液除去杂质,加入碳酸氢铵形成沉淀通过一系列操作得到高纯碳酸锰。
,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰,加入浓硫酸和植物粉浸出过滤得到滤液除去杂质,加入碳酸氢铵形成沉淀通过一系列操作得到高纯碳酸锰。
(1)升温、搅拌都可以加快物质的溶解反应速率,浸出时温度控制在![]() 之间,并且要连续搅拌3小时的目的是提高软锰矿中锰的浸出率;加入植物粉是一种还原剂,正确答案:提高软锰矿中锰的浸出率,作还原剂。
之间,并且要连续搅拌3小时的目的是提高软锰矿中锰的浸出率;加入植物粉是一种还原剂,正确答案:提高软锰矿中锰的浸出率,作还原剂。
(2) ①使用碳酸锰调pH的优势是不引入新的杂质,酸性溶液中二氧化锰氧化过氧化氢为氧气,本身被还原为锰离子,反应的离子方程式为:![]() ;正确答案:增加
;正确答案:增加![]() 的产量(或不引入新的杂质等);
的产量(或不引入新的杂质等);![]() 。
。
(3)根据碳酸氢铵受热易分解分析,温度控制![]() 以下的原因是防止碳酸氢铵分解,在
以下的原因是防止碳酸氢铵分解,在![]() 下,将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在
下,将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在![]() ,得到
,得到![]() 沉淀、硫酸铵、二氧化碳和水,反应的化学方程式为:
沉淀、硫酸铵、二氧化碳和水,反应的化学方程式为:![]() ;生成的MnCO3沉淀需经充分洗涤,洗涤的操作方法是用玻璃棒引流向漏斗中加蒸馏水至刚好浸没沉淀,待水自然流下后,重复操作2-3次;正确答案:减少碳酸氢铵的分解,提高原料利用率;MnSO4+2NH4HCO3
;生成的MnCO3沉淀需经充分洗涤,洗涤的操作方法是用玻璃棒引流向漏斗中加蒸馏水至刚好浸没沉淀,待水自然流下后,重复操作2-3次;正确答案:减少碳酸氢铵的分解,提高原料利用率;MnSO4+2NH4HCO3![]() MnCO3+(NH4)2SO4+CO2↑+H2O;取最后一次的洗涤滤液
MnCO3+(NH4)2SO4+CO2↑+H2O;取最后一次的洗涤滤液![]() mL于试管中,向其中滴加用盐酸酸化的
mL于试管中,向其中滴加用盐酸酸化的![]() 溶液,若无白色沉淀产生,则表明已洗涤干净。
溶液,若无白色沉淀产生,则表明已洗涤干净。
(4) ![]() ,当
,当![]() 沉淀完全时,
沉淀完全时,![]() ,若
,若![]() 也能形成沉淀,则要求
也能形成沉淀,则要求![]() ,
,![]() 的浓度
的浓度![]() 远小于
远小于![]() ,若净化液中的
,若净化液中的![]() ,说明
,说明![]() 的存在不会影响
的存在不会影响![]() 的纯度;正确答案:Ksp(MnCO3)=c(Mn2+)c(CO32-),当Mn2+沉淀完全时,c(CO32-)=1.8×10-11/1.0×10-5=1.8×10-6molL-1,若Mg2+也能形成沉淀,则要求Mg2+>2.6×10-5/1.8×10-6=14.4 molL-1,Mg2+的浓度0.01mol/L远小于14.4 molL-1,若净化液中的c(Mg2+)=10-2mol/L,说明Mg2+的存在不会影响MnCO3的纯度。
的纯度;正确答案:Ksp(MnCO3)=c(Mn2+)c(CO32-),当Mn2+沉淀完全时,c(CO32-)=1.8×10-11/1.0×10-5=1.8×10-6molL-1,若Mg2+也能形成沉淀,则要求Mg2+>2.6×10-5/1.8×10-6=14.4 molL-1,Mg2+的浓度0.01mol/L远小于14.4 molL-1,若净化液中的c(Mg2+)=10-2mol/L,说明Mg2+的存在不会影响MnCO3的纯度。

【题目】某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
实验 序号 | 锌的质量/g | 锌的状态 | c(H2SO4) /mol·L-1 | V(H2SO4) /mL | 反应前溶 液的温度/℃ | 添加剂 |
1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定______________________进行判断,其速率最快的实验是________(填实验序号)。
(2)对锌和稀硫酸反应,实验1和2表明,________对反应速率有影响;实验1和3表明,________对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间 t的图像如下图所示。
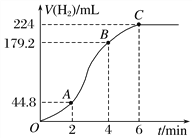
①在OA、AB、BC三段中反应速率最快的是________,原因是______________________。
②2~4 min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)为________________________________________________________________________。
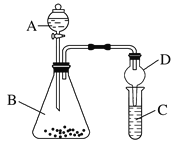
(4)利用如图2装置验证非金属性:C>Si,B中加Na2CO3,C中加Na2SiO3溶液,A中应该加入__________________________,C中反应的化学方程式:________________________,D装置的作用是_______________________________________。


