题目内容
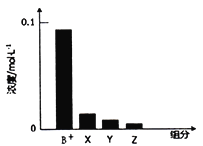
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。 据此下列说法错误的是
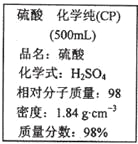
A. 该硫酸具有强烈的腐蚀性,应放于危险化学用品柜中妥善保管
B. 取10 mL该硫酸于烧杯中,再加等体积的水,可配得49%的硫酸
C. 配制200mL4.6 mol·L-1的稀硫酸需取该硫酸50 mL
D. 该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2 mol·L-1
【答案】B
【解析】
A.98![]() 的硫酸为浓硫酸,具有强腐蚀性,属于危险药品,在实验室中应妥善保管,所以A选项是正确的;B.用浓硫酸配制稀硫酸时,要把浓硫酸沿烧杯壁缓缓加入水中,边加边搅拌。若把水加入浓硫酸中,由于浓硫酸遇水放出大量的热引起液体飞溅,会出现安全事故,且所配硫酸的质量分数不等于
的硫酸为浓硫酸,具有强腐蚀性,属于危险药品,在实验室中应妥善保管,所以A选项是正确的;B.用浓硫酸配制稀硫酸时,要把浓硫酸沿烧杯壁缓缓加入水中,边加边搅拌。若把水加入浓硫酸中,由于浓硫酸遇水放出大量的热引起液体飞溅,会出现安全事故,且所配硫酸的质量分数不等于![]() ,故B错误;C.该浓硫酸的物质的量浓度为c=1000
,故B错误;C.该浓硫酸的物质的量浓度为c=1000![]() /M=1000
/M=1000![]() 1.84g/L
1.84g/L![]() 98
98![]() =18.4mol/L,计算根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,则xmL/1000
=18.4mol/L,计算根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,则xmL/1000![]() =200ml
=200ml![]() 4.6mol/L,计算得出:x=50,所以应量取的浓硫酸体积是50mL,所以C选项是正确的;D.该硫酸与等质量的水混合,因为硫酸密度大于水的密度,等质量混合时总体积大于硫酸体积的2倍,则所得溶液的物质的量浓度小于9.2mol.L-1 ,所以D选项是正确的;所以答案为B。
4.6mol/L,计算得出:x=50,所以应量取的浓硫酸体积是50mL,所以C选项是正确的;D.该硫酸与等质量的水混合,因为硫酸密度大于水的密度,等质量混合时总体积大于硫酸体积的2倍,则所得溶液的物质的量浓度小于9.2mol.L-1 ,所以D选项是正确的;所以答案为B。

 阅读快车系列答案
阅读快车系列答案【题目】《天工开物》中记载了古人冶金、制陶瓷、硫磺、火药等的过程,是我国古代闪耀的“科技之光”,下列冶炼铁的过程中发生化学变化的是
A.凡铁场所在有之,其铁浅浮土面,浮者拾之 | B.取来淘洗 | C.入炉熔化 | D.凡铁一炉载土二千余斤,或用硬木柴,或用煤炭,或用木炭,土化成铁 |
|
|
|
|
A. A B. B C. C D. D
【题目】自然界中的物质绝大多数以混合物的形式存在,为了便于研究和利用,常需对混合物进行分离和提纯。下列A、B、C、D是中学常见的混合物分离或提纯的装置。

Ⅰ.请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)碳酸钙悬浊液中分离出碳酸钙___________;
(2)氯化钠溶液中分离出氯化钠___________;
(3)分离植物油和水___________;
(4)海水淡化___________;
(5)氯化钠溶液中分离出水___________;
(6)除去自来水中的Cl﹣等杂质___________;
(7)从碘水中分离出I2___________。
Ⅱ.碘水中提取碘单质的方法如下:
(1)萃取分液
①下列可作为碘水中提取碘单质萃取剂的是___________。
A.酒精 B.苯
②分液漏斗在使用前必须先___________。
③查资料得知:ρ(H2O)>ρ(苯)>ρ(酒精),若用①中所选萃取剂萃取碘水中的碘单质,分液时,水层应由分液漏斗的______端口放出,有机层应由分液漏斗的______端口放出(此问填“上”或者“下”)
(2)蒸馏
①装置A中a的名称是_______,冷凝装置中冷凝水应该________口进(填“上”或“下”),这样做的目的是________________________,装置C在分液时为使液体顺利滴下,除打开漏斗下端的旋塞外,还应进行的具体操作是__________________________。
②已知碘和四氯化碳的熔沸点数据如下表
熔点 | 沸点 | |
碘 | 113.7℃ | 184.3℃ |
四氯化碳 | -22.6℃ | 76.8℃ |
若用蒸馏法分离碘和四氯化碳的混合物,锥形瓶中先收集到的物质的名称是___________。
Ⅲ. 海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:

问题一:粗盐中含Ca2+、Mg2+、SO42﹣等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④调节溶液的pH等于7 ⑤溶解 ⑥过滤 ⑦蒸发正确的操作顺序是__________(填选项字母).
⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
问题二:由海水到氯化钠晶体的实验过程中要用到的主要装置是_________________(从给定的四种装置中选择,填字母)。
问题三:粗盐中含有少量泥沙、CaCl2、MgCl2及硫酸盐,将粗盐溶解后,先过滤将泥沙除去,再检验滤液中的SO42﹣,检验滤液中的SO42﹣的实验操作和现象是_________________________。