题目内容
 已知:
已知:(1)如图
(2)25℃、101kPa下:
①2Na (s)+
| 1 |
| 2 |
②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ/mol
根据以上信息判断,下列说法正确的是( )
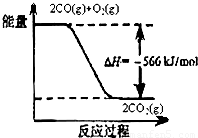
分析:A、由图可知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol,根据燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B、根据钠与氧气在加热条件下反应生成Na2O2;
C、利用盖斯定律计算;
D、根据Na2O中的离子为:Na+、O2-,Na2O2中的离子为:Na+、O22-.
B、根据钠与氧气在加热条件下反应生成Na2O2;
C、利用盖斯定律计算;
D、根据Na2O中的离子为:Na+、O2-,Na2O2中的离子为:Na+、O22-.
解答:解:A、由图可知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol,CO的燃烧热为283kJ/mol,故A错误;
B、钠与氧气在加热条件下反应生成Na2O2,故B错误;
C、①2Na (s)+
O2(g)═Na2O(s)△H1=-414kJ/mol ②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ/mol,①×2-②得,25℃、101 kPa下,Na2O2(s)+2Na(s)═2Na2O(s)△H=-317 kJ/mol,故C正确;
D、Na2O中的离子为:Na+、O2-,Na2O2中的离子为:Na+、O22-,所以Na2O 和Na2O2阴阳离子个数分别为:2:1,2:1,阴阳离子个数比相等,故D错误;
故选:C.
B、钠与氧气在加热条件下反应生成Na2O2,故B错误;
C、①2Na (s)+
| 1 |
| 2 |
D、Na2O中的离子为:Na+、O2-,Na2O2中的离子为:Na+、O22-,所以Na2O 和Na2O2阴阳离子个数分别为:2:1,2:1,阴阳离子个数比相等,故D错误;
故选:C.
点评:本题主要考查了热化学方程式、盖斯定律等运用,难度不大,根据课本知识即可完成.

练习册系列答案
相关题目

 已知H2O2分子的结构如图所示:H2O2分子不是直线型的两个H原子犹如在半展开的书的两线上,氧原子则在书的夹缝上,书页夹角为93°52′,而两个O-H键与O-O键的夹角均为96°52′.
已知H2O2分子的结构如图所示:H2O2分子不是直线型的两个H原子犹如在半展开的书的两线上,氧原子则在书的夹缝上,书页夹角为93°52′,而两个O-H键与O-O键的夹角均为96°52′.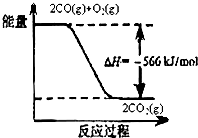
 O2(g)═Na2O(s)△H1=-414kJ/mol
O2(g)═Na2O(s)△H1=-414kJ/mol