题目内容
已知:
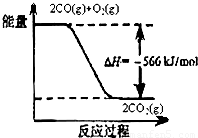
(1)如图
(2)25℃、101kPa下:
①2Na (s)+
O2(g)═Na2O(s)△H1=-414kJ/mol
②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ/mol
根据以上信息判断,下列说法正确的是( )
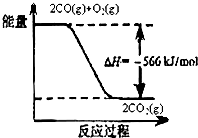
(1)如图
(2)25℃、101kPa下:
①2Na (s)+
| 1 |
| 2 |
②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ/mol
根据以上信息判断,下列说法正确的是( )
| A.CO的燃烧热为283 kJ |
| B.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| C.25℃、101 kPa下,Na2O2(s)+2Na(s)═2Na2O(s) H=-317 kJ/mol |
| D.Na2O 和Na2O2阴阳离子个数比不相等 |

A、由图可知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol,CO的燃烧热为283kJ/mol,故A错误;
B、钠与氧气在加热条件下反应生成Na2O2,故B错误;
C、①2Na (s)+
O2(g)═Na2O(s)△H1=-414kJ/mol ②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ/mol,①×2-②得,25℃、101 kPa下,Na2O2(s)+2Na(s)═2Na2O(s)△H=-317 kJ/mol,故C正确;
D、Na2O中的离子为:Na+、O2-,Na2O2中的离子为:Na+、O22-,所以Na2O 和Na2O2阴阳离子个数分别为:2:1,2:1,阴阳离子个数比相等,故D错误;
故选:C.
B、钠与氧气在加热条件下反应生成Na2O2,故B错误;
C、①2Na (s)+
| 1 |
| 2 |
D、Na2O中的离子为:Na+、O2-,Na2O2中的离子为:Na+、O22-,所以Na2O 和Na2O2阴阳离子个数分别为:2:1,2:1,阴阳离子个数比相等,故D错误;
故选:C.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
 已知:
已知:
 已知H2O2分子的结构如图所示:H2O2分子不是直线型的两个H原子犹如在半展开的书的两线上,氧原子则在书的夹缝上,书页夹角为93°52′,而两个O-H键与O-O键的夹角均为96°52′.
已知H2O2分子的结构如图所示:H2O2分子不是直线型的两个H原子犹如在半展开的书的两线上,氧原子则在书的夹缝上,书页夹角为93°52′,而两个O-H键与O-O键的夹角均为96°52′. O2(g)═Na2O(s)△H1=-414kJ/mol
O2(g)═Na2O(s)△H1=-414kJ/mol