题目内容
【题目】一定温度时,向容积为 2 L 的密闭容器中充入一定量的 SO2(g)和 O2(g),发生反应:2SO2(g)+ O2(g)2SO3(g) △H = - 196 kJ/mol。一段时间后反应达到平衡状态,反应过程中测定的部分数据如表所示。
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 前 5 min 的平均反应速率为υ(SO2) = 0.08 mol/(L·min)
B. 保持温度不变,向平衡后的容器中再充入 0.2 mol SO2(g)和 0.2 mol SO3(g)时,υ正 > υ逆
C. 保持其他条件不变,若起始时向容器中充入 2 mol SO3(g),达到平衡状态时吸收 78.4 kJ的热量
D. 相同温度下,起始时向容器中充入 1.5 mol SO3(g),达到平衡状态时 SO3 的转化率为 40%
【答案】D
【解析】
A.由表中数据可知SO2初浓度=![]() =1mol/L,5min末的浓度=
=1mol/L,5min末的浓度=![]() =0.6mol/L,前 5 min SO2的平均反应速率为υ(SO2) =
=0.6mol/L,前 5 min SO2的平均反应速率为υ(SO2) = ![]() =0.08 mol/(L·min),A项正确;
=0.08 mol/(L·min),A项正确;
B.由表数据计算:第10min时SO2的物质的量![]() ,与第15min时SO2物质的量相同,可推断第10min~15min反应已处于平衡状态,此时SO3的物质的量
,与第15min时SO2物质的量相同,可推断第10min~15min反应已处于平衡状态,此时SO3的物质的量![]() ,平衡常数
,平衡常数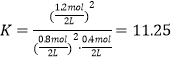 ,保持温度不变(平衡常数不变),向平衡后的容器中再充入 0.2 mol SO2(g)和 0.2 mol SO3(g)时,各组分SO2、O2、SO3物质的量分别是1mol、0.4mol、1.4mol,此时体系的浓度商
,保持温度不变(平衡常数不变),向平衡后的容器中再充入 0.2 mol SO2(g)和 0.2 mol SO3(g)时,各组分SO2、O2、SO3物质的量分别是1mol、0.4mol、1.4mol,此时体系的浓度商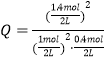 =9.8<K=11.25,浓度商小于平衡常数说明反应向正反应方向进行,υ(正)> υ(逆),B项正确;
=9.8<K=11.25,浓度商小于平衡常数说明反应向正反应方向进行,υ(正)> υ(逆),B项正确;
C.保持其他条件不变起始充入2molSO3,与题设初始量(2molSO2和1molO2)相当,所以达到的平衡与题设平衡等效,即达到平衡时SO3物质的量也为1.2mol,则反应消耗了SO32mol-1.2mol=0.8mol,发生反应的热化学方程式为2SO3(g)2SO2(g)+O2(g),△H =+196 kJ/mol,所以消耗0.8molSO3吸收热量为0.8mol×![]() =78.4kJ,C项正确;
=78.4kJ,C项正确;
D.起始时向容器中充入1.5 mol SO3(g),发生的反应为2SO3(g)2SO2(g)+O2(g),因为此反应与题设反应互为逆反应,平衡常数应与题设反应平衡常数(K=11.25)互为倒数,即只要温度不变,此反应的平衡常数应为![]() 。假定本选项给定的条件下达到平衡状态时 SO3 的转化率为 40%,利用“三段式”计算其平衡常数:
。假定本选项给定的条件下达到平衡状态时 SO3 的转化率为 40%,利用“三段式”计算其平衡常数:
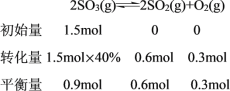
代入平衡常数计算式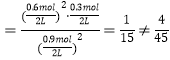 ,
,
所以本选项给定的条件下达到平衡时SO3转化率不可能为40%,D项错误;答案选D。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】.I.(1)常温下三种弱酸 HA、H2B、HC,电离平衡常数的数值为 1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
① HA + HB- (少量)=A-+ H2B ,② H2B(少量) + C-=HB- + HC ,
③ HA(少量) + C-=A-+ HC 。则三种酸对应的电离平衡常数分别为(请填空)
HA | H2B | HC | ||
Ka | Ka1 | Ka2 | Ka3 | Ka4 |
数值 | ________ | ________ | ________ | ________ |
(2)常温下0.1 mol/L HA溶液加水稀释过程,下列表达式数据一定变小是_____。
A.c(A-) B.c(OH-) C.c(H+)c(OH-) D.c(OH-)/c(H+)
E.c(A-)/ c(H+) F. c(H+)/c(HA)
(3)某温度下,体积均为10 mL pH均为2 的HA溶液与HX溶液分别加水稀释至1000 mL,稀释后pH变化为:HA 3.2、HX 3.6,则该温度下HA电离平衡常数_____(填大于、等于或小于)HX,理由是_____;稀释过程中两溶液的c(OH-)将_____(变大、变小或不变)。
II.工业废水中常含有一定量的 Cr2O72- 和 CrO42-,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。
![]()
(4)转化过程中存在平衡 2CrO42- + 2H+![]() Cr2O72- + H2O,该转化过程中溶液颜色变化为_____,能说明反应到达平衡状态的是_____。
Cr2O72- + H2O,该转化过程中溶液颜色变化为_____,能说明反应到达平衡状态的是_____。
A.Cr2O72-和 CrO42-的浓度相同 B.ν正(Cr2O72-)=2 ν逆(CrO42-)
C.溶液的 pH 值保持不变 D.CrO42-不再转化为Cr2O72-
(5)若 1 L 转化后所得溶液中含铬元素质量为 28.6 g,CrO42-有 10/11 转化为Cr2O72-(已知铬元素相对原子质量为 52)。
① 转化后所得溶液中 c(Cr2O72-)=_____。
② 请写出该反应的平衡常数表达式 K=_________,已知:常温下该反应的平衡常数 K=1014,上述转化后所得溶液的 pH 为_____。





