题目内容
已知:2Fe+3Cl2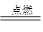 2FeCl3,下列说法正确的是(设nA为阿伏加德罗常数的数值)
2FeCl3,下列说法正确的是(设nA为阿伏加德罗常数的数值)
| A.氯气是氧化剂,FeCl3是还原剂 |
| B.常温下,与56g Fe反应断裂1.5 nA个Cl—Cl键 (相对原子质量:Fe-56) |
| C.1 L 0.1 mol?L-1 FeCl3溶液中含有0.1 nA个Fe3+ |
| D.常温常压下,22.4 L的Cl2和足量Fe反应转移3 nA个电子 |
B
解析试题分析:观察化学方程式,氯元素由0价升为—1价,铁元素由0价降为+3价,铁单质是还原剂,氯气是氧化剂,氯化铁是氧化产物和还原产物,故A选项错误;由于n=m/M,则n(Fe)=1mol,则2Fe+3Cl2 2FeCl3中氯气与铁的系数之比等于物质的量之比,则n(Cl2)=1.5mol,由于氯气的结构式为Cl—Cl,则1.5molCl2分子中含有1.5molCl—Cl键,故B选项正确;由于n=c?V,则氯化铁的物质的量为0.1mol,由于氯化铁是强酸弱碱盐,铁离子少部分水解,则溶液中铁离子小于0.1mol,故C选项错误;由于n=V/Vm,常温常压下气体摩尔体积大于22.4L/mol,则n(Cl2)<1mol,由于2Fe+3Cl2
2FeCl3中氯气与铁的系数之比等于物质的量之比,则n(Cl2)=1.5mol,由于氯气的结构式为Cl—Cl,则1.5molCl2分子中含有1.5molCl—Cl键,故B选项正确;由于n=c?V,则氯化铁的物质的量为0.1mol,由于氯化铁是强酸弱碱盐,铁离子少部分水解,则溶液中铁离子小于0.1mol,故C选项错误;由于n=V/Vm,常温常压下气体摩尔体积大于22.4L/mol,则n(Cl2)<1mol,由于2Fe+3Cl2 2FeCl3~6e—中转移电子与氯气的系数之比等于物质的量之比,则该反应中转移电子小于3mol,故D选项错误。
2FeCl3~6e—中转移电子与氯气的系数之比等于物质的量之比,则该反应中转移电子小于3mol,故D选项错误。
考点:考查阿伏加德罗常数,涉及体积、气体摩尔体积、物质的量、氧化还原反应、物质的量在化学或电离方程式计算中的应用、物质的量浓度、强电解质、物质的组成、水的离子积、溶液的pH、电离方程式等。

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
设NA为阿伏加德罗常数的值。下列说法中正确的是
| A.在密闭容器中加入1 mol N2和3 mol H2,充分反应生成NH3分子数为2NA |
| B.标准状况下,4.48 L N2所含的共用电子对数0.2NA |
| C.常温常压下,1 mol NaHSO4晶体中含有2NA个离子 |
| D.标准状况下,1 mol Fe与2.24 L Cl2反应转移的电子数为3NA |
下列有关表示不正确的是
| A | B | C | D |
| 丁烷分子的球棍模型 | 质量数为A,中子数为a的X原子 | 邻羟基苯甲醛分子内氢键 | 放热反应的能量变化 |
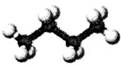 | A aX | 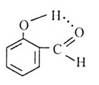 | 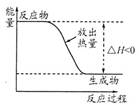 |
设NA表示阿伏加德罗常数的值。下列说法正确的是
| A.45gHCHO与CH3COOH混合物含氢原子数为3NA |
| B.常温常压下,54g重水(D2O)含水分子数为3NA |
| C.标准状况下,11.2L苯含有C-H键数目为3NA |
| D.反应KIO3+6HI=3I2+KI+3H2O,每生成1.5mol I2转移电子数为3NA |
设NA 为阿伏加德罗常数的数值,下列说法正确的是
| A.1mol NO2与足量H2O反应,转移电子数为2NA |
| B.22.4L2H2O中所含的中子数为10NA |
| C.100mL 1mol?L-1AlCl3溶液中含的阳离子数大于0.1NA |
| D.78g的Na2O2含阴离子2NA |
下列化学用语书写正确的是
A.NaHS水解反应:HS-+ H2O H3O++ S2- H3O++ S2- |
B.用两个铜片作电极电解盐酸的初始阶段:Cu+2H+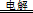 H2↑+Cu2+ H2↑+Cu2+ |
| C.Fe3O4与稀硝酸反应:Fe3O4+8H+ = Fe2++2Fe3++4H2O |
| D.碳酸氢钠溶液中加入过量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O |
设nA是阿伏加德罗常数的数值。下列说法正确的是
| A.1L 0.1mol·L-1的FeCl3溶液中,Fe3+的数目为0.1nA |
| B.1molNH3中含有N-H键的数目为3nA |
| C.7.8g Na2O2中含有的阳离子数目为0.1nA |
| D.标准状况下,22.4L水中分子个数为nA |
下列有关化学用语表示正确的是
| A.Mg2+的电子排布式:1s22s22p63s2 |
B.铁的原子结构示意图: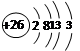 |
C.Na2S的电子式: 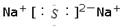 |
| D.次氯酸的结构式:H-Cl-O |
下列说法正确的是( )
| A.摩尔是七个基本物理量之一 |
| B.1mol氢 |
| C.摩尔是表示物质的数量单位 |
| D.每摩尔物质都含有阿伏加德罗常数个指定微粒 |