题目内容
7.一包混有杂质的Na2CO3,其中杂质可能是Ba(NO3)2、KCl、NaHCO3中的一种或多种.今取10.6g 样品,溶于水得澄清溶液,另取10.6g样品,加入足量的盐酸,收集到4.4g CO2,则杂质是KCl和NaHCO3.分析 先根据混合物溶于水为澄清溶液排除硝酸钡;再利用极值法计算出10.6g碳酸氢钠、碳酸钠分别于盐酸反应生成二氧化碳的质量,从而可判断混合物的组成情况.
解答 解:混有杂质的碳酸钠加水后溶液澄清,一定不存在Ba(NO3)2;
纯净的碳酸钠10.6克时,会生成二氧化碳4.4克,纯净的碳酸氢钠10.6克生成的二氧化碳为:$\frac{10.6g}{84g/mol}$×44g/mol≈5.55g>4.4g,
KCl的不与盐酸反应生成二氧化碳,会导致生成的二氧化碳的量偏小;
现在取10.6克样品,加入足量的盐酸,收集到4.4gCO2,说明碳酸钠中的杂质与盐酸反应生成的二氧化碳与碳酸钠与盐酸反应的情况相同,
则混合液物中一定存在KCl和NaHCO3,
故答案为:KCl和NaHCO3.
点评 本题考查了混合物反应的计算,题目难度中等,明确常见物质的性质及发生反应原理为解答关键,注意掌握极值法在化学计算中应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
15.下列试剂中可用于鉴别Fe2+和Fe3+的是( )
①NaOH溶液 ②酸性KMnO4溶液 ③KSCN溶液 ④Fe粉.
①NaOH溶液 ②酸性KMnO4溶液 ③KSCN溶液 ④Fe粉.
| A. | ①③ | B. | ①②③ | C. | ①③④ | D. | ①②③④ |
12. 某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
(1)用A、B、O表示这类特殊晶体的化学式ABO3.在图中,与A原子配位的氧原子数目为12.
(2)基态Cr原子的核外电子排布式为1s22s22p63s23p63d54s1,其中电子的运动状态有24种.
(3)某些钙钛型复合氧化物能够催化NO直接分解为N2和O2,N和O的基态原子中,未成对的电子数目比为3:2.
(4)下表是几种碳酸盐的热分解温度和阳离子半径
请解释碳酸钙热分解温度最低的原因:碳酸盐的热分解是由于晶体中的阳离子结合碳酸根中的氧离子,使碳酸根分解为二氧化碳分子的结果.钙离子由于半径小和氧离子结合更为容易,氧化钙晶格能大,所以碳酸钙分解温度低.
(5)用晶体的X射线衍射法可以测得阿伏伽德罗常数.对金属钙的测定得到以下结果:晶胞为面心立方最密堆积,边长为a pm,阿伏加德罗常数的值为NA,金属钙的密度为$\frac{1.6×1{0}^{32}}{{N}_{A}•{a}^{3}}$g•cm-3(用含a和NA的式子表示).
 某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).(1)用A、B、O表示这类特殊晶体的化学式ABO3.在图中,与A原子配位的氧原子数目为12.
(2)基态Cr原子的核外电子排布式为1s22s22p63s23p63d54s1,其中电子的运动状态有24种.
(3)某些钙钛型复合氧化物能够催化NO直接分解为N2和O2,N和O的基态原子中,未成对的电子数目比为3:2.
(4)下表是几种碳酸盐的热分解温度和阳离子半径
| 碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 900 | 1172 | 1360 |
| 阳离子半径/pm | 99 | 112 | 135 |
(5)用晶体的X射线衍射法可以测得阿伏伽德罗常数.对金属钙的测定得到以下结果:晶胞为面心立方最密堆积,边长为a pm,阿伏加德罗常数的值为NA,金属钙的密度为$\frac{1.6×1{0}^{32}}{{N}_{A}•{a}^{3}}$g•cm-3(用含a和NA的式子表示).
19.在实验室里可用如图1所示装置制取氯酸钾、次氯酸钠并探究氯水的性质.
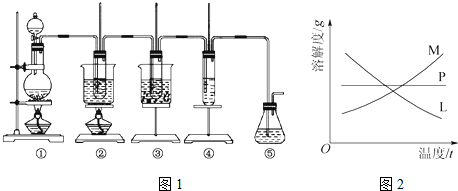
图中:①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于热水浴中;③的试管里盛有15mL8%NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置.
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗(填写仪器名称)向烧瓶中加入适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(填字母)的净化装置.
A.碱石灰 B.饱和食盐水
C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是碱溶液(或反应物)的浓度不同,反应温度不同.
反应完毕经冷却后,②的试管中有大量晶体析出.图2中符合该晶体溶解度曲线的是M(填字母);从②的试管中分离出该晶体的方法是过滤(填实验操作名称).
(3)本实验中制取次氯酸钠的离子方程式是Cl2+2OH-═ClO-+Cl-+H2O.
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:

图中:①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于热水浴中;③的试管里盛有15mL8%NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置.
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗(填写仪器名称)向烧瓶中加入适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(填字母)的净化装置.
A.碱石灰 B.饱和食盐水
C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是碱溶液(或反应物)的浓度不同,反应温度不同.
反应完毕经冷却后,②的试管中有大量晶体析出.图2中符合该晶体溶解度曲线的是M(填字母);从②的试管中分离出该晶体的方法是过滤(填实验操作名称).
(3)本实验中制取次氯酸钠的离子方程式是Cl2+2OH-═ClO-+Cl-+H2O.
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为黄绿色 | 继续通入的氯气溶于水使溶液呈黄绿色 |
16.关于卤代烃的说法正确的是( )
| A. | 卤素原子是卤代烃的官能团.C-X之间的共用电子对偏向卤原子,形成一个极性较强的共价键,分子中C-X键易断裂 | |
| B. | 卤代烃难溶于水,易溶于大多数有机溶剂,常温下均呈液态,且密度均>1 g/cm3 | |
| C. | 强碱的水溶液中均可发生水解反应;在强碱的醇溶液中加热均可发生消去反应 | |
| D. | 卤素原子的检验步骤:①取少量卤代烃;②加入NaOH溶液;③加热煮沸;④冷却;⑤加入硝酸银溶液 |
17.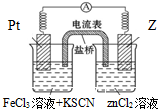 298K时,在FeCl3溶液中加少量锌粒后,Fe3+被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )
298K时,在FeCl3溶液中加少量锌粒后,Fe3+被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )
 298K时,在FeCl3溶液中加少量锌粒后,Fe3+被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )
298K时,在FeCl3溶液中加少量锌粒后,Fe3+被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )| A. | 正极电极反应为Zn-2e-═Zn2+ | |
| B. | 左边烧杯中溶液的红色变浅 | |
| C. | Pt电极上有气泡出现 | |
| D. | 该电池的总反应为:3Zn+2Fe3+═3Zn2++2 Fe |


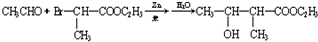 ,
,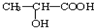 通过以下路线可合成(G):
通过以下路线可合成(G):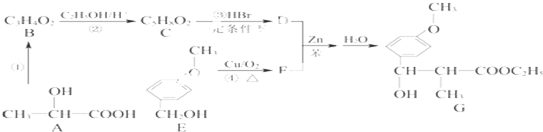
 .
.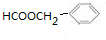 .
.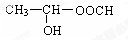 .
.