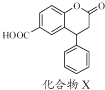
题目内容
【题目】下列有关性质比较不正确的是( )
A.晶体熔点的高低: 
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF>NaCl>NaBr>NaI
【答案】C
【解析】解:A.因为对位形成分子间氢键增大熔点,邻位形成分子内氢键降低熔点,所以晶体熔点的高低: ![]() >
> 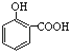 ,故A正确;
,故A正确;
B、原子晶体中化学键键能越大、键长越短其硬度越大,这几种物质都是原子晶体,键长C﹣C<C﹣Si<Si﹣Si,所以硬度:金刚石>碳化硅>晶体硅,故B正确;
C、Na、Mg、Al原子半径依次减小,金属离子电荷逐渐增多,金属键逐渐增强,则熔点由高到低:Al>Mg>Na,故C错误;
D、晶格能与离子半径成反比,与电荷成正比,离子半径,F﹣<Cl﹣<Br﹣<I﹣ , 则晶格能NaF>NaCl>NaBr>NaI,故D正确;
故选C.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目