题目内容
【题目】二氧化氯(ClO2)是一种优良的消毒剂,熔点为-59℃,沸点为11℃,浓度过高时易发生分解,甚至爆炸。某课外兴趣小组通过氯气与NaClO2溶液反应来制取少量ClO2,装置如下图所示:
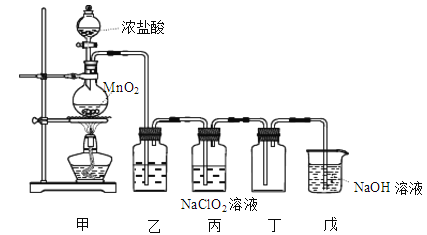
(1)甲装置中圆底烧瓶内发生反应的化学方程式是______。
(2)丙装置中发生的反应可能经两步完成,请将其补充完整:①______(用化学方程式表示),②HClO + HCl + 2NaClO2 = 2ClO2↑+ 2NaCl + H2O。
(3)Clˉ存在时会催化ClO2的生成,若无乙装置,则丙装置内产生ClO2的速率明显加快。实验过程中常需通入适量的N2稀释ClO2,其目的是______。写出氯气制漂白液的化学方程式并用双线桥表示电子转移的方向与数目______。
(4)戊装置烧杯中NaOH溶液吸收ClO2后,生成了ClO-、ClO3-,该反应的离子方程式是______。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O Cl2+H2O
MnCl2+Cl2↑+2H2O Cl2+H2O![]() HCl+HClO 防止ClO2发生分解,甚至爆炸
HCl+HClO 防止ClO2发生分解,甚至爆炸 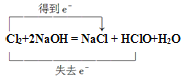 2ClO2+2OH-= ClO2-+ClO3-+H2O
2ClO2+2OH-= ClO2-+ClO3-+H2O
【解析】
(1)甲装置中二氧化锰与浓盐酸在加热条件下反应生成MnCl2、Cl2与H2O;
(2)由第②步反应中反应物可知,第①步是氯气与水反应生成HCl与HClO;
(3)ClO2浓度过高时易发生分解,甚至爆炸;Cl2溶解于NaOH溶液生成NaCl、NaClO和水,Cl2既是氧化剂又是还原剂;
(4)NaOH溶液吸收ClO2后,生成了ClO2-、ClO3-,根据电子转移守恒、电荷守恒、原子守恒配平。
(1)甲装置中二氧化锰与浓盐酸在加热条件下反应生成MnCl2、Cl2与H2O,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)由第②步反应中反应物可知,第①步是氯气与水反应生成HCl与HClO,反应方程式为:Cl2+H2OHCl+HClO;
(3)ClO2浓度过高时易发生分解,甚至爆炸,所以通入适量的N2稀释ClO2;Cl2溶解于NaOH溶液生成NaCl、NaClO和水,发生反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,其中Cl元素的化合价既升高又降低,用双线桥分析电子转移方向和数目为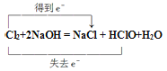 ;
;
(4)NaOH溶液吸收ClO2后,生成了ClO2-、ClO3-,反应离子方程式为:2ClO2+2OH-=ClO2-+ClO3-+H2O。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_________________________________。
(2)该反应的正反应为____________反应(填“吸热”、“放热”)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______________℃。此温度下加入1molCO2(g)和1molH2(g),充分反应,达到平衡时,CO2的转化率为__________。
(4)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol/L ,c(H2)为1.5mol/L,c(CO)为1mol/L, c(H2O)为3mol/L,则正、逆反应速率的比较为υ正________υ逆 。(填“>”、“<”或“=”)
【题目】(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。那么用太阳能分解10mol水消耗的能量是____________kJ;
(2)由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(i)CO(g) + 2H2(g) = CH3OH(g) △H1 = -90.1kJmol-1
(ii)CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H2 = -49.0kJmol-1
水煤气变换反应:
(iii)CO(g) + H2O(g) = CO2(g) + H2 (g) △H3 = -41.1kJmol-1
二甲醚合成反应:
(iV)2 CH3OH(g) = CH3OCH3(g) + H2O(g) △H4 = -24.5kJmol-1
则由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为____________。
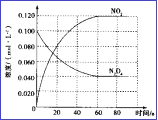
(3)在容积为1.00L的容器中,通入一定量N2O4,发生N2O4(g) ![]() 2NO2(g), 100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,v(N2O4)=_______________________,
2NO2(g), 100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,v(N2O4)=_______________________,
(4)已知反应2HI(g)=H2(g) + I2(g)的ΔH= +11kJ·mol-1,1molH2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___________kJ。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数, 若k正 = 0.0027min-1,在t=40min时,v正=_______min-1

