题目内容
| . |
| v |
A.
| B.
| ||||
C.
| D.
|
| ||
| 30s |
A、根据速率之比等于化学计量数之比,所以v(O2)=
| 5 |
| 4 |
| 5 |
| 4 |
B、半分钟后NO的物质的量浓度增加了0.3mol,所以用NO表示的反应速率为v(NO)=
| ||
| 30s |
C、根据速率之比等于化学计量数之比,所以v(H2O)=1.5v(NO)=1.5×0.002mol/(L?s)=0.003mol/(L?s),故C正确;
D、根据速率之比等于化学计量数之比,所以v(NH3)=v(NO)=0.002mol/(L?s),故D错误.
故选:C.

化工行业的发展必须符合国家节能减排的总体要求。请回答下列问题:
(1)已知C(s)+H2O(g) CO(g)+H2(g),则该反应的平衡常数表达式为 。
CO(g)+H2(g),则该反应的平衡常数表达式为 。
(2)已知在一定温度下,
C(s)+CO2(g)
 2CO(g)
△H1
2CO(g)
△H1
CO(g)+H2O(g)
 H2(g)+CO2(g)
△H2
H2(g)+CO2(g)
△H2
C(s)+H2O(g) CO(g)+H2(g) △H3
CO(g)+H2(g) △H3
则△H1、△H2、△H3之间的关系是: 。
(3)通过研究不同温度下平衡常数可以解决某些实际问题。已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应: CO(g)+H2O(g)  H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
则该反应的正反应方向是 反应(填“吸热”或“放热”),在500℃时,若设起始时CO和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g)  2NO2(g)
△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :
2NO2(g)
△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
(5)工业上用Na2SO3吸收尾气中的SO2,再用下图装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为: ,阳极区逸出气体的成分为 (填化学式)。

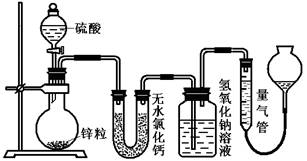
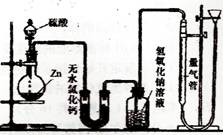 硫酸可以被还原为SO2,也可被还原为氢气。为
硫酸可以被还原为SO2,也可被还原为氢气。为