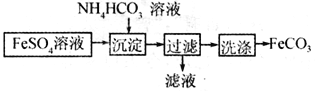
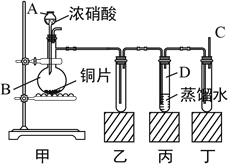
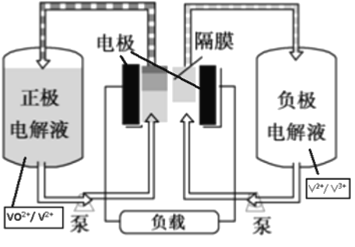
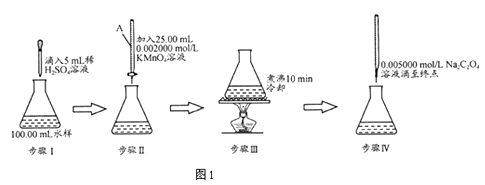
题目内容
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是
A. 0.5mol/LCuCl2溶液中含有的Cl-数目为NA
B. 42gC2H4和C4H8的混合气中含有氢原子数为6NA
C. 标准状况下,H2和CO混合气体4.48L在足量O2中充分燃烧消耗O2分子数为0.1NA
D. 在反应4Cl2+8NaOH=6NaCl+NaClO+NaClO3+4H2O中,消耗1molCl2时转移的电子总数为1.5NA
【答案】A
【解析】选项A中没有说明溶液的体积,所以无法计算,选项A错误。设42gC2H4和C4H8的混合气中,C2H4和C4H8的质量分别为X和Y,则X+Y=42。混合物中的氢原子为![]() 。选项B正确。氢气和氧气燃烧,CO和氧气燃烧时,燃料气和氧气的体积比都是2:1,所以H2和CO混合气体燃烧时,需要的氧气也是混合气体的一半。所以标准状况下,H2和CO混合气体4.48L(0.2mol)在足量O2中充分燃烧消耗O2分子数为0.1NA,选项C正确。反应4Cl2+8NaOH=6NaCl+NaClO+NaClO3+4H2O中,转移电子数为6e-,所以有4molCl2参加反应应该转移6mole-,所以消耗1molCl2时转移的电子总数为1.5NA。选项D正确。
。选项B正确。氢气和氧气燃烧,CO和氧气燃烧时,燃料气和氧气的体积比都是2:1,所以H2和CO混合气体燃烧时,需要的氧气也是混合气体的一半。所以标准状况下,H2和CO混合气体4.48L(0.2mol)在足量O2中充分燃烧消耗O2分子数为0.1NA,选项C正确。反应4Cl2+8NaOH=6NaCl+NaClO+NaClO3+4H2O中,转移电子数为6e-,所以有4molCl2参加反应应该转移6mole-,所以消耗1molCl2时转移的电子总数为1.5NA。选项D正确。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目