题目内容
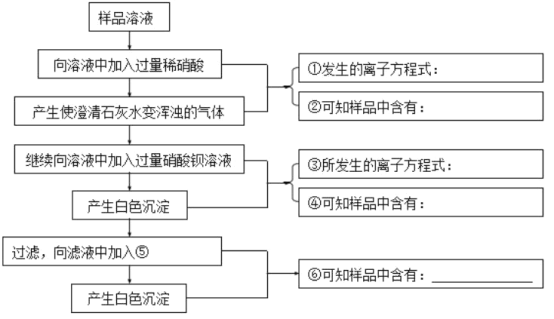
【题目】某碳酸钠样品中可能含有少量的硫酸钠和氯化钠。某学生为检验其成分,按照如图所示步骤进行实验,请将相关内容填入相应横线处。________、________、________、________、________、________。
【答案】2H++CO32-=H2O+CO2↑ 碳酸钠(或Na2CO3) SO42-+Ba2+=BaSO4↓ 硫酸钠(或Na2SO4) 硝酸银溶液 氯化钠(或NaCl)
【解析】
假设样品中含有Na2CO3、NaCl、Na2SO4,则该题目的分析思路如下表所示:
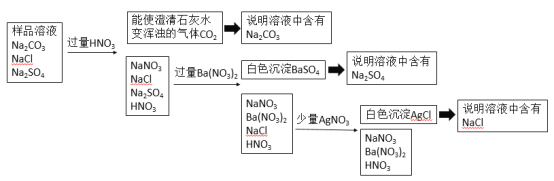
假设样品中含有Na2CO3、NaCl、Na2SO4,
①由题可知,样品溶液中一定含有Na2CO3,故加入过量的HNO3,发生反应CO32-+2H+=H2O+CO2↑;
②产生的气体能使澄清石灰水变浑浊,则该气体为为CO2,来自于Na2CO3和HNO3的反应,从而说明样品中含有Na2CO3;
③加入过量HNO3后,溶液中剩余NaCl、NaNO3、Na2SO4、HNO3,加入过量Ba(NO3)2后产生白色沉淀BaSO4,方程式为:SO42-+Ba2+=BaSO4↓;
④白色沉淀BaSO4说明样品中含有Na2SO4,因为只有Na2SO4会和Ba(NO3)2反应;
⑤加入过量Ba(NO3)2后,溶液中有NaCl、NaNO3、Ba(NO3)2、HNO3,需要加入AgNO3溶液才能产生白色沉淀,因为硝酸盐都溶于水,只能有Cl-形成沉淀;
⑥加入AgNO3后产生白色沉淀AgCl,说明样品中含有NaCl。

练习册系列答案
相关题目