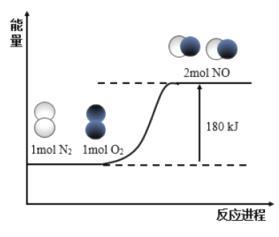
题目内容
【题目】化学上把外加少量酸、碱,而pH基本不变的溶液,称为缓冲溶液。现有25℃时,浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76,已知:Ka(CH3COOH)=1.75×10-5,Kb为盐的水解常数。回答下列问题:
(1)写出CH3COONa水解的离子方程式______。
(2)该缓冲溶液中除水分子外,所有粒子浓度由大到小的顺序______。
(3)25℃时,Ka(CH3COOH)______Kb(CH3COO-)(填“>”、“<”或“=”)。
(4)人体血液存在H2CO3(CO2)与NaHCO3的缓冲体系,能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定,有关机理说法正确的是______(填写选项字母)。
a.代谢产生的H+被HCO3-结合形成H2CO3
b.血液中的缓冲体系可抵抗大量酸、碱的影响
c.代谢产生的碱被H2CO3中和转化为HCO3-
【答案】CH3COO-+H2OCH3COOH+OH- c(CH3COO-)>c(Na+)>c(H+)>c(OH-) > ac
【解析】
(1)CH3COONa水解生成醋酸和NaOH;
(2)可以根据CH3COOH和CH3COONa的缓冲溶液,pH=4.76,呈酸性,结合电荷守恒分析解答;
(3)浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76,说明醋酸电离程度大于醋酸钠水解程度,也可以计算出Kb再判断;
(4)H2CO3(CO2)与NaHCO3的缓冲体系中H2CO3(CO2)能中和人体代谢产生的少量碱,同时NaHCO3又可吸收人体代谢产生的少量H+,有效除掉人体正常代谢产生的酸或碱,保持pH的稳定,据此分析解答。
(1)CH3COONa水解生成醋酸和NaOH,离子方程式为CH3COO-+H2OCH3COOH+OH-,故答案为:CH3COO-+H2OCH3COOH+OH-;
(2) 0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76,呈酸性,即c(H+)>c(OH-),以醋酸的电离为主,电荷守恒为c(H+)+c(Na+)=c(OH-)+c(CH3COO-),所以溶液中离子浓度由大到小的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(3)浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液呈酸性,说明CH3COOH的电离程度大于CH3COONa的水解程度,即Ka(CH3COOH)>Kb(CH3COO-),实际上Kb=![]() =
=![]() =
=![]() ×10-9,故答案为:>;
×10-9,故答案为:>;
(4)a.人体血液中存在H2CO3H++HCO3-平衡,人体代谢产生的H+与HCO3-结合形成H2CO3,随血液带到肺部分解生成二氧化碳和水,故a正确;b.血液中的缓冲体系可抵抗少量酸或碱的影响,不能抵抗大量酸或碱的影响,否则缓冲溶液失去作用、出现酸或碱中毒,故b错误;c.代谢产生的碱性物质进入血液时,立即被H2CO3中和成HCO3-,经过肾脏调节排除体外,同时H+又可由H2CO3电离补充,维持血液pH的稳定,故c正确;故答案为:ac。

 阅读快车系列答案
阅读快车系列答案