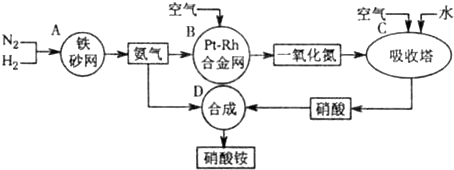
题目内容
在密闭容器中使3.62g NaOH、Na2S、Na2SO3的混合物溶于50mL某浓度的稀硫酸中,不放出任何气体,再加入100mL 0.10mol·L-1的Ba(OH)2溶液,正好中和过量的硫酸,将反应所得沉淀洗净、烘干、称重,其质量为3.29g.求原混合物中各物质的质量.
答案:
解析:
解析:
|
解:由方程2Na2S+Na2SO3+3H2SO4=3S↓+3Na2SO4+3H2O 2NaOH+H2SO4=Na2SO4+2H2O Ba(OH)2+Na2SO4=BaSO4↓+2H2O ∴Ba(OH)2 ~ BaSO4 n(S)= 1mol 233g n(Na2S)=0.03mol× 0.1mol·L-1×0.1L 233g n(Na2SO3)=0.03mol× ∴m(Na2S)=0.02mol×78g·mol-1=1.56g m(Na2SO3)=0.01mol×126g·mol-1=1.26g m(NaOH)=3.62g-1.56g-1.26g=0.80g |

练习册系列答案
相关题目
近年来,各国加速推进燃料电池的研发.燃料电池的燃料有氢气、甲醇等.
(1)通过下列硫--碘循环工艺可制得燃料电池的燃料氢气:
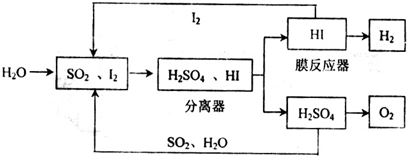
①该循环工艺过程的总反应方程式为 .
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是
(2)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l);△H=-283.0kJ?mol-1…①
2CH3OH(1)+3O2(g)→2CO2(g)+4H2O(1);△H=-726.0kJ?mol-1…②
写出二氧化碳与氢气合成甲醇液体的热化学方程式 .
(3)甲醇--空气燃料电池是利用稀土金属氧化物作为固体电解质,这种稀土金属氧化物在高温下能传导O2-.
①负极发生的反应是
②在稀土金属氧化物的固体电解质中,O2-.的移动方向是 .
(4)已知反应2CH30H?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此 温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小v正 v逆 (填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,该时间内反应速率v(CH30H)= .
(1)通过下列硫--碘循环工艺可制得燃料电池的燃料氢气:

①该循环工艺过程的总反应方程式为
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是
(2)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l);△H=-283.0kJ?mol-1…①
2CH3OH(1)+3O2(g)→2CO2(g)+4H2O(1);△H=-726.0kJ?mol-1…②
写出二氧化碳与氢气合成甲醇液体的热化学方程式
(3)甲醇--空气燃料电池是利用稀土金属氧化物作为固体电解质,这种稀土金属氧化物在高温下能传导O2-.
①负极发生的反应是
②在稀土金属氧化物的固体电解质中,O2-.的移动方向是
(4)已知反应2CH30H?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此 温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,该时间内反应速率v(CH30H)=
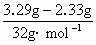 =0.03mol
=0.03mol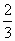 =0.02mol
=0.02mol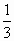 =0.01mol
=0.01mol