题目内容
X、Y、Z三种元素都是短周期的主族元素。X是同周期主族元素中原子半径最大的元素;Y元素的原子的最外层电子数是其所在周期数的二倍;Z元素原子的最外层电子数是其所在周期数的三倍。下列有关叙述中正确的是
A. 用惰性电极电解由X、Y、Z形成的化合物的水溶液,电解后溶液的pH值一定增大
B. 由X、Y、Z形成的化合物的分子式一定为X2YZ3
C. 由X、Y、Z形成的化合物的水溶液可能呈酸性、中性或碱性。
D. X元素形成的单质晶体可能为金属晶体,Y、Z两元素形成的单质晶体一定为分子晶体
已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005mol/(L·s)。下列说法正确的是
A.4 s时c(B)为0.38 mol/L
B.830℃达平衡时,A的转化率为20%
C.反应达平衡后,升高温度,平衡正向移动
D.1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数为0.4
A(g)+B(g)的平衡常数为0.4
在1L 恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g )
) M(g)+N(s),所得实验数据如下表:
M(g)+N(s),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | n(N) | ||
① | 800 | 0.10 | 0.40 | 0.080 | 0.080 |
② | 800 | 0.20 | 0.80 | a | a |
③ | 900 | 0.10 | 0.15 | 0.06 | 0.06 |
下列说法不正确的是:
A.实验①中,5min达平衡,用X表示的平均反应速率v(X)=0.016mol/(L·min)
B.实验②中,该反应的平衡常数K=12.5
C.实验②中,达到平衡时,a大于0.16
D.正反应为放热反应


 CuSO4+SO2↑+2H2O
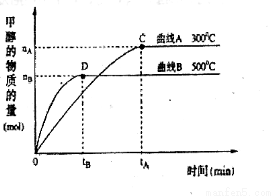
CuSO4+SO2↑+2H2O CH3OH(g) △H,反应过程中生成1mol CH3OH(g)的能量变化如 右下图所示。曲线Ⅰ、Ⅱ分别表示无或有催化剂两种情况。下列判断正确的是
CH3OH(g) △H,反应过程中生成1mol CH3OH(g)的能量变化如 右下图所示。曲线Ⅰ、Ⅱ分别表示无或有催化剂两种情况。下列判断正确的是 Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
 CH3OH(g)。升高温度,K值 (填“增大”、“减小”或“不变”)。在500℃,从反应开始到达到平衡,用氢气浓度变化表示的平均反应速率v(H2)= 。
CH3OH(g)。升高温度,K值 (填“增大”、“减小”或“不变”)。在500℃,从反应开始到达到平衡,用氢气浓度变化表示的平均反应速率v(H2)= 。 下,在0.20L的0.002mol/LMgSO4溶液中加入等体积的0.10mol/L的氨水溶液,该温度下电离常数Kb(NH3·H2O)=2×10-5,试计算 (填“有”或“无”) Mg(OH)2沉淀生成?
下,在0.20L的0.002mol/LMgSO4溶液中加入等体积的0.10mol/L的氨水溶液,该温度下电离常数Kb(NH3·H2O)=2×10-5,试计算 (填“有”或“无”) Mg(OH)2沉淀生成? 析该溶液遇酚酞呈红色原因时,
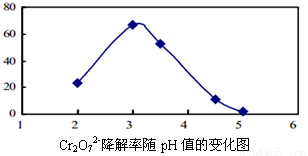
析该溶液遇酚酞呈红色原因时,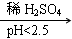 Cu +CuSO4;酸性越大,Cr2O72-被还原率越大。
Cu +CuSO4;酸性越大,Cr2O72-被还原率越大。