题目内容
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:

(1)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化的曲线是 填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。 则 m1 m2 ( 选填“<”、“=”、“>”)。[来
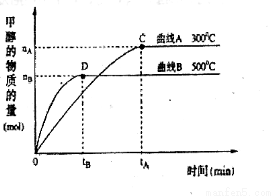
(2)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。升高温度,K值 (填“增大”、“减小”或“不变”)。在500℃,从反应开始到达到平衡,用氢气浓度变化表示的平均反应速率v(H2)= 。
CH3OH(g)。升高温度,K值 (填“增大”、“减小”或“不变”)。在500℃,从反应开始到达到平衡,用氢气浓度变化表示的平均反应速率v(H2)= 。
(3)某温度下Ksp[ Mg(OH)2] = 2×10 -11,若该温度下某MgSO4溶液里c(Mg 2+) =0.002 mol·L-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于 ;该温度 下,在0.20L的0.002mol/LMgSO4溶液中加入等体积的0.10mol/L的氨水溶液,该温度下电离常数Kb(NH3·H2O)=2×10-5,试计算 (填“有”或“无”) Mg(OH)2沉淀生成?
下,在0.20L的0.002mol/LMgSO4溶液中加入等体积的0.10mol/L的氨水溶液,该温度下电离常数Kb(NH3·H2O)=2×10-5,试计算 (填“有”或“无”) Mg(OH)2沉淀生成?
(4)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。在分 析该溶液遇酚酞呈红色原因时,
析该溶液遇酚酞呈红色原因时, 甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。
甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。 请你设计一个
请你设计一个 简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) 。
简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) 。
某小组同学欲探究0.1 mol/L Fe3+溶液与 0.1 mol/L S2-溶液的反应。小组同学先进行理论预测,提出如下三种可能:
a.Fe3+与 S2-发生复分解反应
b.Fe3+与 S2-发生 反应
c.Fe3+与 S2-发生互促水解反应
(1)依据预测a 写出该反应的离子方程式
(2)将预测b补充完整 ,说明预测依据 。
在进行实验验证前,先进行资料收集,得到如下信息:
物质 | 颜色 | 水中溶解性 |
Fe2S3 | 黑色 | 难溶于水 |
FeS | 黑褐色 | 难溶于水 |
进行如下实验:
实验步骤 | 操作 | 现象 | 备注 |
1 | 向2 mL 0.1 mol/L氯化铁溶液中逐滴滴入3滴0.1 mol/L 硫化钠溶液 | 产生黑色沉淀, 立即变为黄色沉淀,未见其它明显现象 | 自始至终都未见红褐色沉淀 |
2 | 继续滴加3滴0.1 mol/L 硫化钠溶液 | 同上 | |
3 | 继续滴加0.1 mol/L 硫化钠溶液至过量 | 产生黑色沉淀,振荡后静置,未发现明显变化 |
(3)写出黑色沉淀转变为黄色沉淀的离子方程式
为进一步探究反应实质,该组同学进行了如下实验:
实验步骤 | 操作 | 现象 |
4 | 向2 mL 0.1 mol/L硫化钠溶液中逐滴滴入3滴0.1 mol/L 氯化铁溶液 | 产生黑色沉淀,未见其它明显现象 |
5 | 继续滴加3滴0.1 mol/L 氯化铁溶液 | 同上 |
6 | 继续滴加0.1 mol/L 氯化铁溶液至过量 | 同上 |
(4)步骤4与步骤1现象不同的原因可能是
(5)有同学认为步骤3中产生的黑色沉淀中可能有FeS。请判断他的想法是否合理并说明理由
(6)依据以上实验现象,可得出结论:_________________________。


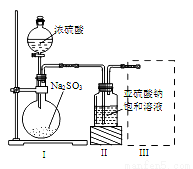
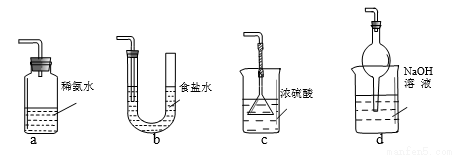


 论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中错误的是
论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中错误的是 O2 已知该反应中H2O2只发生如下过程:H2O2→O2
O2 已知该反应中H2O2只发生如下过程:H2O2→O2