题目内容
【题目】25℃时,在20.0 mL 0.10mol/L 氨水中滴入0.10 mol/L的盐酸。溶液的pH与所加盐酸的体积关系如图所示。已知氨水的电离度为1.32%,下列有关叙述正确的是( )
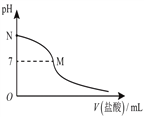
A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0 mL
C. M点处的溶液中![]()
D. N点处的溶液中![]()
【答案】D
【解析】A选项,强酸弱碱相互滴定时,由于生成强酸弱碱盐使溶液显酸性,而石蕊的变色范围为5﹣8,滴定终点不在石蕊的变色范围内,应选择甲基橙,A错误;B选项,假设M点盐酸体积为20.0mL,则二者恰好完全反应生成氯化铵,氯化铵溶液应该呈酸性,由图可知,M点溶液呈中性,则氨水应该稍微过量,所以盐酸体积小于20.0mL,故B错误;C选项,M处溶液呈中性,则存在c(H+)=c(OH﹣),根据电荷守恒得c(NH4+)=c(Cl﹣),该点溶液中溶质为氯化铵和一水合氨,水解和电离均是微弱的,溶质离子应大于c(H+)和c(OH﹣),该点溶液中离子浓度大小顺序是c(NH4+)=c(Cl﹣)>c(H+)=c(OH﹣),故C错误;D选项,N点为氨水溶液,氨水浓度为0.10molL﹣1,该氨水电离度为1.32%,则该溶液中c(OH﹣)=0.10mol/L×1.32% =1.32×10﹣3 mol/L,c(H+)= ![]() =7.6×10﹣12mol/L,所以该点溶液pH<12,故D正确。故选D。
=7.6×10﹣12mol/L,所以该点溶液pH<12,故D正确。故选D。

 习题精选系列答案
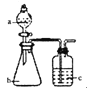
习题精选系列答案【题目】用如图所示装置和相应试剂能达到实验目的是:
选项 | 实验目的 | 试剂a | 试剂b | 试剂c | 装置 |
A | 验证非金属性:S>C>Si | 稀硫酸 | Na2CO3 | Na2SiO3溶液 |
|
B | 制备纯净的氯气 | 浓盐酸 | MnO2 | 饱和食盐水 | |
C | 检验溶液X中含有CO32- | 盐酸 | 溶液X | 澄清石灰水 | |
D | 除去Na2CO3中的Na2SO4 | 氯水 | 混合物 | NaOH溶液 |
A. A B. B C. C D. D