题目内容
【题目】KMnO4具有强氧化性,在实验室和工业上常用作氧化剂。某化学兴趣小组采用标准的酸性KMnO4溶液测定可能发生变质的还原性物质Na2SO3固体中Na2SO3的含量。
(1)简述检验Na2SO3已经变质的操作和现象:取少量样品于试管中,加水溶解,__________。
(2)另取10.0 g试样配成250 mL溶液,配制溶液时,可能用到的玻璃仪器有量筒、烧杯、玻璃棒、________。取出25.00 mL所配制的Na2SO3溶液于锥形瓶中,用标准酸性KMnO4溶液滴定,采用的指示剂是________(如果不需要,可写“无”)。判断滴定实验达到终点的方法是________________。反应的离子方程式为SO32-+MnO4-+H+→SO42-+Mn2++H2O(未配平)。重复操作四次,消耗0.10 mol·L-1 KMnO4溶液的体积如下:
1 | 2 | 3 | 4 | |
KMnO4(mL) | 20.01 | 19.00 | 19.99 | 20.00 |
Na2SO3 (mL) | 25.00 | 25.00 | 25.00 | 25.00 |
求样品中Na2SO3的质量分数_________________。
(3)操作时,若未用0.10 mol·L-1的酸性KMnO4溶液润洗滴定管,会导致测定结果________(填“偏高”、“偏低”或“没有影响”)。
【答案】 先加入过量盐酸,再加入氯化钡溶液,如果有白色沉淀生成,表明Na2SO3已经变质 250 mL容量瓶、胶头滴管 无 当最后一滴酸性KMnO4溶液滴入锥形瓶后,瓶内溶液变成浅粉红色且半分钟内不褪色 63% 偏高
【解析】(1)亚硫酸钠易被氧化为硫酸钠而变质,可以通过检验硫酸根离子检验Na2SO3已经变质,操作和现象为:取少量样品于试管中,加水溶解,先加入过量盐酸,再加入氯化钡溶液,如果有白色沉淀生成,表明Na2SO3已经变质。(2)另取10.0 g试样配成250 mL溶液,配制溶液时,可能用到的玻璃仪器有量筒、烧杯、玻璃棒、250 mL容量瓶、胶头滴管。由于酸性高锰酸钾溶液显紫红色,所以用标准酸性KMnO4溶液滴定时不需要指示剂,判断滴定实验达到终点的方法是当最后一滴酸性KMnO4溶液滴入锥形瓶后,瓶内溶液变成浅粉红色且半分钟内不褪色。根据表中数据可知第二次实验误差较大,舍去。三次实验中消耗标准液体积的平均值是20.00mL,根据电子得失守恒可知25mL溶液中亚硫酸钠的物质的量是![]() ,因此样品中Na2SO3的质量分数为
,因此样品中Na2SO3的质量分数为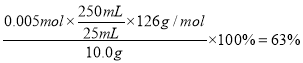 。(3)操作时,若未用0.10 mol·L-1的酸性KMnO4溶液润洗滴定管,会导致浓度降低,消耗标准液体积增加,因此测定结果偏高。
。(3)操作时,若未用0.10 mol·L-1的酸性KMnO4溶液润洗滴定管,会导致浓度降低,消耗标准液体积增加,因此测定结果偏高。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案